Sandrogreco Teoria AtôMica Q. Geral
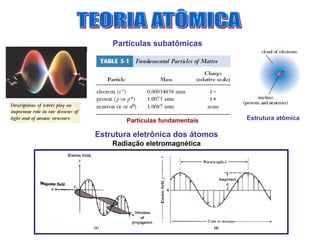
- 1. Partículas subatômicas Partículas fundamentais Estrutura atômica Estrutura eletrônica dos átomos Radiação eletromagnética
- 2. Radiação eletromagnética •A teoria atômica moderna surgiu a partir de estudos sobre a interação da radiação com a matéria.
- 3. A cor da luz depende de sua freqüência ou comprimento de onda Dispersão da luz visível por um prisma
- 5. Radiação eletromagnética Energia quantizada e fótons Planck: a energia só pode ser liberada (ou absorvida) por átomos em certos pedaços de tamanhos mínimos, chamados quantum. A relação entre a energia e a frequência é onde h é a constante de Planck (6,626 x 10-34 J s). Equação Energia é diretamente proporcional à freqüência de Planck
- 6. Efeito fotoelétrico •Einstein supôs que a luz trafega em pacotes de energia denominados fótons. E = hν Nenhum elétron é ejetado até que a radiação tenha freqüência acima de um determinado valor, característico do metal; Os elétrons são ejetados imediatamente, por menor que seja a radiação; A energia cinética dos elétrons ejetados aumenta linearmente com a freqüência da radiação incidente. O efeito fotoelétrico fornece evidências para a natureza de partícula da luz - “quantização”.
- 7. Espectro atômico e o modelo de Bohr Espectros de linhas de emissão - linhas espectrais Espectros de linhas A radiação composta por um único comprimento de onda é chamada de monocromática. A radiação que se varre uma matriz completa de diferentes comprimentos de onda é chamada de contínua. A luz branca pode ser separada em um espectro contínuo de cores. Observe que não há manchas escuras no espectro contínuo que corresponderiam a linhas diferentes. Um objetivo dos cientistas do final do século XIX era explicar por que os átomos gasosos emitem luz de somente determinadas freqüências e encontrar uma relação matemática entre as freqüências observadas.
- 8. Equação de Balmer-Rydberg 1 ⎛ RH ⎞⎛ 1 1 ⎞ onde RH é a constante de Rydberg (1,096776 x 107 m-1), =⎜ ⎟⎜ 2 − 2 ⎟ λ ⎝ h ⎠⎜ n1 n2 ⎟ h é a constante de Planck (6,626 x 10-34 J·s), ⎝ ⎠ n1 e n2 são números inteiros (n2 > n1). O modelo de Bohr ( ) ⎛ 1 ⎞ E = − 2. 18 × 10 −18 J ⎜ ⎟ ⎝ n2 ⎠ n = no quântico principal As cores de gases excitados surgem devido ao movimento dos elétrons entre os estados de energia no átomo.
- 11. O modelo de Bohr A primeira órbita no modelo de Bohr tem n = 1, é a mais próxima do núcleo e NÍVEIS ESPECTRO N convencionou-se que ela tem M L 6 energia negativa. 5 ENERGIA K CRESCENTE é 4 núcleo A órbita mais distante no é 3 nível 1 (n = 1) = K é modelo de Bohr tem n é 2 nível 2 (n = 2) = L nível 3 (n = 3) = M 1 próximo ao infinito e ENERGIA nível 4 (n = 4) = N CRESCENTE corresponde à energia zero. Os elétrons no modelo de Bohr podem se mover apenas entre órbitas através da absorção e da emissão de energia em quantum (hν). ⎛ 1⎞ ΔE = hν = = − 2.18 ×10 J 2 − 2 ⎟ hc λ ( −18 ⎜ 1 ⎜n ni ⎟ ) ⎝ f ⎠ Quando ni > nf, a energia é emitida. Quando nf > ni, a energia é absorvida.
- 12. Elétron como partícula-onda Em 1924, Louis de Broglie, em sua tese de Doutorado, fez uma proposta revolucionária baseada nos trabalhos de Max Plank, Arthur Compton e Albert Einstein (mecânica quântica). Para descrever o elétron, Louis de Broglie considerou que tanto onda como matéria são energias e, portanto podem ser igualadas. A partir de sua hipótese, o elétron tem comportamento corpuscular (matéria) e ondulatório e passa a ser conhecido como partícula-onda. Surge então, O Princípio da dualidade do elétron. h λ= mv Em 1927, com visão dualística para o elétron (mecânica quântica), Werner Heisenberg apresentou uma restrição matemática quanto às características do elétron. O seu trabalho estabeleceu que não fosse possível determinar com precisão, em um dado momento, a posição e o momento do elétron. Logo não é possível conhecer, simultaneamente, a posição e a energia do elétron. Esta restrição ficou conhecida como Princípio da incerteza de Heisenberg. h Se Δx é a incerteza da posição e Δmv é Δx·Δmv ≥ a incerteza do momento, então: 4π
- 13. Equação de Schrödinger Equação de Schrödinger: Em 1926 e 1927, Erwin Schrödinger publicou seis trabalhos científicos que estabeleceram uma equção que possibilitou relacionar a energia do sistema eletrônico com suas propriedades ondulatórias, para qualquer elétron, de qualquer átomo, de todos os elementos químicos. psi = função de onda, trata-se de um sistema dualístico h2 Energia total do sistema = EΨ = x (v2Ψ) + vΨ Energia potencial 2 8π m Energia cinética δ2 δ2 δ2 onde, v2 = + + x, y e z são coordenadas de espaço. δx 2 δy 2 δz 2 m e h são a massa do elétron e a constante de Plank, respectivamente. A função de onda fornece o contorno do orbital eletrônico. O quadrado da função de onda fornece a probabilidade de se encontrar o elétron, isto é, dá a densidade eletrônica para o átomo.
- 14. Orbitais e números quânticos A solução da equação de Shrödinger impõe três restrições que são conhecidos como números quânticos: número quântico principal (n) especifica o nível de energia do elétron como também o volume da região do espaço onde o elétron se encontra; número quântico secundário (l) determina a forma da região do espaço onde o elétron será encontrado; número quântico magnético (ml), este no não especifica energia, mas sim a orientação espacial da região no espaço onde o elétron poderá ser encontrado (orbital).
- 15. Orbitais atômicos Orbitais s À medida que n aumenta, aumenta o número de nós. Um nó é uma região no espaço onde a probabilidade de se encontrar um elétron é zero. Em um nó, ψ2 = 0 Para um orbital s, o número de nós é n-1.
- 16. Orbitais p As letras correspondem aos valores permitidos de ml, -1, 0, e +1. Os orbitais têm a forma de halteres. À medida que n aumenta, os orbitais p ficam maiores. Todos os orbitais p têm um nó no núcleo.
- 17. Orbitais d e f Existem cinco orbitais d e sete orbitais f. Três dos orbitais d encontram-se em um plano bissecante aos eixos x-, y- e z. Dois dos orbitais d se encontram em um plano alinhado ao longo dos eixos x-, y- e z. Quatro dos orbitais d têm quatro lóbulos cada. Um orbital d tem dois lóbulos e um anel.
- 18. Átomos polieletrônicos O espectro de linhas de átomos polieletrônicos mostra cada linha como um par de linhas minimamente espaçado. Stern e Gerlach planejaram um experimento para determinar o porquê. Um feixe de átomos passou através de uma fenda e por um campo magnético e os átomos foram então detectados. Duas marcas foram encontradas: uma com os elétrons girando em um sentido e uma com os elétrons girando no sentido oposto. Spin eletrônico
- 19. Spin eletrônico e o princípio da exclusão de Pauli Na presença de um campo magnético, podemos elevar a degeneração dos elétrons.
- 20. O princípio da construção - distribuição eletrônica As configurações eletrônicas nos dizem em quais orbitais os elétrons de um elemento estão localizados. Três regras: Os orbitais são preenchidos em ordem crescente de n.
- 21. O princípio da construção - distribuição eletrônica Dois elétrons com o mesmo spin não podem ocupar o mesmo orbital (Pauli). Para os orbitais degenerados, os elétrons preenchem cada orbital isoladamente antes de qualquer orbital receber um segundo elétron (regra de Hund).
- 22. O princípio da construção - distribuição eletrônica É experimentalmente observada que o elétron ocupa o orbital disponível que propicie ao átomo a menor energia possível (Regra n + 1).
- 23. Configurações eletrônicas e a tabela periódica A tabela periódica pode ser utilizada como um guia para as configurações eletrônicas. O número do periodo é o valor de n. Os grupos 1A e 2A têm o orbital s preenchido. Os grupos 3A -8A têm o orbital p preenchido. Os grupos 3B -2B têm o orbital d preenchido. Os lantanídeos e os actinídeos têm o orbital f preenchido.
- 24. Configurações eletrônicas e a tabela periódica
