Ácidos e bases: propriedades e indicadores
- 1. Quando uma substância se dissolve em água, forma-se uma mistura homogénea que se designa por solução aquosa. As soluções aquosas podem ser • Ácidas • Básicas (ou Alcalinas) • Neutras O pH é um parâmetro que permite avaliar o grau de acidez ou de basicidade de uma solução. À temperatura de 25ºC, as soluções com pH<7 são ácidas, as soluções com pH=7 são neutras e as soluções com pH>7 são básicas.
- 3. Soluções aquosas ácidas As soluções aquosas ácidas contêm substâncias dissolvidas chamadas ácidos. Exemplos de ácidos Ácido Fórmico Ácido Cítrico Ácido Málico Ácido Fosfórico Ácido Acético Ácido Tartárico Soluções aquosas básicas As soluções aquosas básicas contêm substâncias dissolvidas chamadas bases. Exemplos de bases Hidróxido de magnésio Hidróxido de sódio Hidróxido de amónio Bicarbonato de sódio Soluções Ácidas Algumas propriedades: * têm sabor azedo; * reagem com os metais; * conduzem a corrente eléctrica. Soluções Básicas Algumas propriedades: * têm sabor amargo; * conduzem a corrente eléctrica; * são escorregadias.
- 4. Indicadores de ácido-base Indicadores designam-se às substâncias que, em contacto com soluções ácidas ou básicas, mudam de cor, sendo por isso, utilizadas para indicar o carácter ácido ou básico de uma solução. • solução alcoólica de fenolftaleína (incolor); • tintura azul tornesol (azul arroxeado). Indicadores Solução ácida Solução neutra Solução básica Solução alcoólica de fenolftaleína Incolor Incolor carmim Tintura azul de tornesol vermelho azul arroxeado azul arroxeado Exemplos
- 5. A solução alcoólica de fenolftaleína é incolor Na presença de soluções básicas toma a cor carmim A tintura azul de tornesol é azul arroxeada Na presença de soluções ácidas toma a cor vermelha
- 6. Indicador Universal é uma mistura de vários indicadores, uns naturais outros sintéticos. Apresenta-se quer em solução (a), quer impregnado em papel (b), apresentando uma grande variedade de cores consoante a acidez ou basicidade da solução. O Indicador Universal Indicadores de ácido-base (a) (b)
- 7. EXERCÍCIOS A - têm sabor azedo; B - tornam carmim a fenolftaleína; C - conduzem a corrente eléctrica; D - avermelham a tintura azul de tornesol; E - têm sabor amargo; 1- Soluções ácidas 2 - Soluções básicas A - Soda cáustica B - Vinagre C - Limão D - Maçã E - Formigas F - Cal apagada 1 - ácido cítrico 2 - ácido fórmico 3 - hidróxido de sódio 4 - ácido acético 5 - hidróxido de cálcio 6 - ácido málico Recorda as características das soluções ácidas e básicas e faz a associação correspondente. Faz a correspondência correta entre as duas colunas.
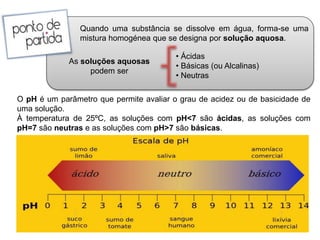
- 8. A Escala de pH
- 9. EXERCÍCIOS
- 10. EXERCÍCIOS
- 11. Água da chuva, água destilada e água pura
- 12. Será que … … a água da chuva é pura? Não. Porque a água límpida (das nuvens) é um bom solvente, capaz da dissolver muitos dos gases que existem na atmosfera, sobretudo nas camadas mais baixas. … a água destilada no laboratório é pura? Não. Como a água é um solvente excelente, durante a destilação há substâncias que são arrastadas pelo vapor de água e acabam por aparecer outra vez na água destilada. Há possibilidade de novas substâncias surgirem no destilado (gases dissolvidos no ar). … a água pura existe? Não. No entanto, o conceito de pureza é relativo; uma mesma água pode ser suficientemente pura para um determinado fim (ex: rega), mas não ser para outro (ex: beber).
- 13. “Todos nós, no dia a dia, temos contacto com ácidos e bases. Por exemplo quando usamos o vinagre no tempero de uma salada, quando usamos o sumo de limão ou até mesmo o sumo de uma maçã, estamos perante um ácido, ou então quando utilizamos um produto para desentupir canalizações estamos perante um base. Mesmo um adubo, que é utilizado numa plantação como fonte de azoto para as plantas, é um composto que resultou de uma reação com uma base, o amoníaco. Os ácidos são parte fundamental do nosso processo digestivo. Geralmente o ácido caracteriza-se por ser algo azedo, enquanto que a base por ser algo escorregadio ao tato. O conceito de ácido e de base é algo que é extremamente importante para a química moderna, quer no dia a dia, quer ao nível da indústria química, e foram desenvolvidos conceitos para interpretar ao nível microscópico o comportamento destas substâncias.” ÁCIDOS E BASES http://www.e-escola.pt/
- 14. ÁCIDOS E BASES
- 15. ÁCIDOS E BASES Svante August Arrhenius (Séc XIX) Definiu, os ácidos como sendo substâncias que, em solução aquosa, se dissociavam produzindo iões H+ enquanto as bases se dissociavam produzindo iões OH-. TEORIA DE Arrhenius - Teoria iónica
- 16. ÁCIDOS E BASES
- 17. ÁCIDOS E BASES Brønsted & Lowry (Séc XIX) Consideraram a reação ácido-base como um processo de transferência de um protão de uma espécie química (ácido) para outra (base). TEORIA DE Brønsted & Lowry - Teoria protónica.
- 18. ÁCIDOS E BASES
- 19. ÁCIDOS E BASES
- 20. ÁCIDOS E BASES
- 21. ÁCIDOS E BASES
- 22. EXEMPLOS – pares ácido-base conjugados NH4 +/NH3 H2O/OH- HCl/Cl – H3O+/H2O
- 23. EXEMPLOS – pares ácido-base conjugados Soluções
- 24. EXEMPLOS – pares ácido-base conjugados R: (a)
- 25. O conceito de pH O pH de uma solução é a medida da sua acidez, basicidade ou neutralidade. Estudo do conceito de pH recorrendo à substância água (H2O).
- 26. O conceito de pH Estudo do conceito de pH recorrendo à substância água (H2O). Esta reação chama-se auto-ionização ou autoprotólise da água. A expressão da constante de equilíbrio. Como em soluções muito diluídas [H2O] é praticamente constante, logo: Kw - produto iónico da água (depende da temperatura) e e e e e e e e
- 27. O conceito de pH Estudo do conceito de pH recorrendo à substância água (H2O). Kw (25ºC) = 110-14 e e
- 28. Qual será o valor do pH da água a 25º C? O conceito de pH Estudo do conceito de pH recorrendo à substância água (H2O). A concentração de iões hidrónio (concentração hidrogeniónica: [H3O+]) determina o pH da água e de soluções aquosas. pH = - log [H3O+] Como [H3O+] = 110-7 mol dm-3 pH = - log (110-7) pH = 7
- 29. O conceito de pH O caráter ácido, básico ou neutro de uma solução é determinado pela relação entre os valores das concentrações de iões hidrónio [H3O+] e iões hidróxido [OH-]. Assim, para qualquer temperatura:
- 30. O conceito de pH Podemos também definir pOH: pOH = - log [OH-] Relação entre pH e pOH pH + pOH = pKw pKw = - log Kw À temperatura de 25ºC: pH + pOH = 14 EXERCÍCIOS Determine o valor de pH de cada uma das seguintes soluções (a 25ºC), cuja concentração de iões hidrónio é: i. 110-7 mol dm-3 ii. 110-6 mol dm-3 iii. 510-6 mol dm-3 iv. 110-5mol dm-3 v. 2,310-4 mol dm-3
- 31. Variação do Kw com a temperatura O quadro ao lado apresenta valor de Kw para diferentes temperaturas, para a auto-ionização da água. CONCLUSÕES: T (ºC) Kw pH 0 0,1140 10-14 7,47 10 0,2930 10-14 7,27 20 0,6810 10-14 7,08 25 1,008 10-14 7,00 30 1,471 10-14 6,92 40 2,916 10-14 6,77 50 5,476 10-14 6,63 100 51,30 10-14 6,14 aumento da temperatura aumento de Kw a reação de auto-ionização da água é endotérmica O pH da água diminui com o aumento da temperatura
- 32. Se o pH da água diminuir com o aumento da temperatura, será que significa que a água vai ficar mais ácida a temperaturas superiores? Variação do Kw com a temperatura Uma solução é ácida quando tem excesso de iões H3O+ em relação aos iões OH-. Na água “pura” existe sempre igual número de iões H3O+ e iões OH-. Por isto, a água terá de permanecer neutra, mesmo com alteração do seu pH, mas a condição de neutralidade deixa de ser pH=7, para temperaturas diferentes de 25ºC.
- 33. EXERCÍCIO R: 1º Método Kw = 7,244 10-14 pKw = - log (7,244 10-14) pKw = 13,14 pKw = pH + pOH e pH = pOH pH = pKw/2 pH = 6,57 Qual será, para a água, o valor de pH neutro , à temperatura de 55 ºC, se Kw = 7,244 10-14? R: 2º Método Kw =[H3O+] [OH-] e [H3O+] =[OH-] [H3O+] = [H3O+] = 2,69 10-7 pH = - log (2,69 10-7) pH = 6,57 14 107,244
- 34. EXERCÍCIO R: Como a ionização é completa: [H3O+] = 0,030 mol dm-3 pH + pOH = pKw - log (0,030) + pOH = - log (5,0 10-14) 1,52 + pOH = 13,30 pOH = 13,30 -1,52 pOH = 11,78 Considere uma solução aquosa de ácido clorídrico, HCl , de concentração 0,030 mol dm-3, à temperatura de 50 ºC, completamente ionizado. Determine o valor do pOH da solução. Dado: Kw (50 ºC) = 5,0 10-14
- 35. Dissociação e Ionização A dissolução de NaOH em água é qualitativamente diferente da dissolução de NH3. NaOH é um composto iónico formado por iões Na+ e OH-. Os ácidos também são ionizados - reagem com a água para formar iões Dissociação NH3 é um composto molecular formado por moléculas. )()()( aqaqaq OHNaNaOH )()(4)(2)(3 aqaqlaq OHNHOHNH Ionização )(3)(2)( )( aqaqaq OHCllOHHCl Dissociação Ionização • Ocorre em sais (incluindo hidróxidos) • Separação dos iões existentes • Iões são solvatados (rodeados por moléculas de solvente) • Ocorre em ácidos e algumas bases • Reação com o solvente para formar iões • Separação dos iões formados • Iões são solvatados
- 37. FORÇA DOS ÁCIDOS E DAS BASES A força de um ácido está ligada à sua capacidade de se ionizar, nomeadamente numa solução aquosa. São ácidos fortes aqueles que, em solução aquosa, se ionizam extensamente e são ácidos fracos aqueles que, também em solução aquosa, se ionizam em percentagem reduzida. Isto é, os ácidos fortes apresentam um grau de ionização elevado e, consequentemente, uma concentração de H3O+ elevada na solução, enquanto que para os ácidos fracos verifica-se uma baixa concentração de H3O+ na respetiva solução. São bases fortes as bases que se ionizam quase completamente, em solução aquosa, nos seus iões (incluindo, portanto, os iões OH-); são bases fracas aquelas cuja ionização, também em solução aquosa, seja bastante restrita. Tal como acontece para os ácidos, também para as bases existem bases fortes e bases fracas. Grau de ionização ()
- 38. FORÇA DOS ÁCIDOS E DAS BASES • Como exemplo de uma base fraca temos o amoníaco. O amoníaco é uma base, uma vez que é capaz de receber um protão mas, em soluções aquosas, não se encontra totalmente ionizado, uma vez que é uma base mais fraca do que o ião OH- que seria gerado quando este captasse um protão cedido pela água, de acordo com a equação abaixo: NH3(g) + H2O (l) ↔ NH4 + (aq) + OH-(aq) Exemplo de base forte e fraca • Como exemplo de base forte temos o hidróxido de sódio (NaOH). Esta base pode considerar-se completamente ionizada quando, dissolvida em água, a concentração dos iões OH- for aproximadamente igual à concentração inicial da base NaOH. NaOH(s) → Na+ (aq) + OH- (aq)
- 39. FORÇA DOS ÁCIDOS E DAS BASES O valor da constante de ionização Ka é obtido da mesma forma que se obtém a constante de equilíbrio em uma solução aquosa : HCl = H+ + Cl- Como determinar a força do ácido? A força do ácido é um parâmetro determinado através da sua constante de ionização Ka . Quanto maior o valor Ka , maior a quantidade de iões H3O+ em solução e como consequência mais forte é o ácido. A constante de ionização (Ka) é um valor semelhante à constante de equilíbrio, portanto varia apenas com a temperatura. Existem outras técnicas para perceber quando um ácido é forte ou não. 1) 2) Suponha um ácido do tipo HySOx , se o valor x-y for maior ou igual a 2 , o ácido pode ser considerado forte. Observação : No lugar do átomo S poderia estar outro átomo. Se o ácido for do tipo HX onde X é um átomo qualquer da família dos halogênios, o ácido também é considerado forte. 2.1) 2.2)
- 40. FORÇA DOS ÁCIDOS E DAS BASES Se a solução for a de um ácido monoprótico forte, a concentração de H3O+ na solução é aproximadamente igual à do ácido porque a reação de ionização é praticamente completa, e o grau de ionização aproximadamente igual a 1. Para efetuar o cálculo do pH de uma solução é preciso conhecer a concentração de H3O+. )(3)(2)( )( aqaqaq OHCllOHHCl EXERCÍCIOS Determine o pH de uma solução de ácido clorídrico, HCl, 0,15 mol dm-3. Como o ácido é forte, ioniza-se completamente, logo [HCl]=[H3O+] 0,15 mol dm-3. Então como pH = -log [H3O+] pH = -log (0,15) = 0,82 R:
- 42. EXERCÍCIOS R: A reação de ionização é traduzida pela equação seguinte: HNO3 (aq) + H2O (l) NO3 - (aq) +H3O+ (aq) Como a ionização é completa, o grau de ionização igual a 1, [H3O+]final = [HNO3]inicial, pelo que [H3O+]final = 5,0 x 10-2 mol dm-3, o que implica que pH = -log 5,0 x 10-2, isto é, pH = 1,3. Determine, a 25 ºC, o pH de uma solução aquosa de ácido nítrico, HNO3, 5,0 x 10-2 mol dm-3 Notas: • Para soluções aquosas de bases fortes, como NaOH e KOH, hidróxido de sódio e hidróxido de potássio, respetivamente, a determinação da concentração de OH- é efetuada de um modo semelhante à determinação da concentração de H3O+ para ácidos fortes. • Para soluções aquosas de ácidos ou bases fracas, a concentração de H3O+ e/ou OH- vai depender da constante de equilíbrio da reação em causa, uma vez que estas reações de ionização não são completas.
- 43. A reação de ionização é traduzida pela equação seguinte: CH3COOH (aq) + H2O (l) H3O+ (aq) + CH3COO- (aq) Quando se atinge o equilíbrio, para o mesmo volume, os valores das concentrações das espécies químicas são: [CH3COOH]equilíbrio = 5,0 x 10-2 – x ; [CH3COO-]equilíbrio = x ; [H3O+] = x A partir do valor de Ka do ácido, à temperatura referida, pode determinar-se o valor de x e a partir deste o pH da solução. Determine, a 25 ºC, o pH de uma solução aquosa de ácido acético, CH3COOH, 5,0 x 10-2 mol dm-3. EXERCÍCIOS R:
- 44. A reação de ionização é traduzida pela equação seguinte: HCl (aq) + H2O (l) Cl- (aq) + H3O+ (aq) O grau de ionização ser 1, significa que o ácido está completamente ionizado, logo [HCl ] = [H3O+] = 0,1 mol dm-3 ; [HCl ]= 0 mol dm-3 e como [H3O+] [OH- ]= 1 10-14 [OH- ] = 1 10-13 mol dm-3 O ácido clorídrico é um ácido forte ( 1). Quais as concentrações de H3O+, OH- e 0,1 mol dm-3 a 25ºC? EXERCÍCIOS R:
- 45. O número de moléculas ionizadas de água é igual ao número de iões hidrónio e igual ao número de iões hidróxido. H2O (l) + H2O (l) OH- (aq) + H3O+ (aq) Kw= [H3O+] [OH- ]= 51,3 10-14 como [H3O+] =[OH- ] = mol dm-3 Em 1 dm3 de água, a 100 ºC, existem 7,16 10-7 moles de moléculas ionizadas. (H2O) = 1g cm-3 = 1000 g dm-3 O nº de moles de H2O em 1 dm-3 é 1000/18,02 =55,5 mol O produto iónico da água a 100 ºC é 51,3 10-14. Calcule o grau de ionização da água a essa temperatura: Dados: (H2O) = 1g cm-3 M(H2O) = 18,02 g mol-1 EXERCÍCIOS R: 714 1016,7103,51 8 7 10290,1 5,55 1016,7 iniciais ionizadas n n
- 46. TITULAÇÃO ÁCIDO-BASE Os ácidos e as bases fortes estão completamente ionizados/ dissociados em solução aquosa. Assim pode-se escrever: )(2)()()( laqaqaq OHNaClNaOHHCl )()()( aqaqaq OHNaNaOH A mistura de HCl e NaOH, pode ser traduzida pela equação química: )(2)()()()()(3)( 2 laqaqaqaqaqaq OHNaClOHNaOHCl Como se observa, há partículas que: • efetivamente reagem , H3O+ e OH-; • são apenas iões espetadores , Cl- e Na+. A reação inversa da auto-ionização da água é muito extensa Esta reação pode considerar-se completa, resultando um sal neutro, cloreto de sódio. REAÇÃO DE NEUTRALIZAÇÃO )(3)()(2)( aqaqlaq OHClOHHCl Equação geral:
- 47. TITULAÇÃO ÁCIDO-BASE Titulação ácido-base (volumetria ácido-base) – permite determinar a concentração desconhecida de um ácido (uma base) numa solução – titulado – fazendo reagir essa solução com uma base (um ácido) de concentração conhecida – titulante. Titulante Titulado
- 49. TITULAÇÃO ÁCIDO-BASE Numa titulação ácido-base adiciona-se titulante ao titulado até se atingir o ponto de equivalência Momento em que ambos reagem estequiometricamente nácido = nbase cácido Vácido = cbase Vbase Apenas válido para estequiometria monoácido/monobase (1: 1). Como sabemos que se atingiu o ponto de equivalência? -No ponto de equivalência verifica-se uma variação brusca do pH -Pode ser detetado utilizando um indicador de ácido-base adequado, adicionado ao titulado. Este muda de cor no ponto de equivalência. - Na realidade o que é detetado é o ponto final – momento em que o ponto de equivalência é ultrapassado. - Se o indicador for bem escolhido, o ponto de equivalência e o ponto final são próximos.
- 50. TITULAÇÃO ÁCIDO-BASE Como escolher o indicador? Teremos que saber o ponto de equivalência, através da curva de titulação. Curvas de Titulação O indicador adequado é aquele cuja zona de viragem contém o ponto de equivalência. Ou Qualquer indicador cuja zona de viragem esteja contida na zona abrupta da curva.
- 51. TITULAÇÃO ÁCIDO-BASE Curvas de Titulação
- 52. TITULAÇÃO ÁCIDO-BASE pH inicial do titulado (base) Próximo do ponto de equivalência há uma variação brusca do pH: (de 11 para 3,6) Ponto de equivalência (zona de inflexão) Volume de titulante (ácido) gasto para atingir o ponto de equivalência
- 54. EXERCÍCIO Observe a seguinte figura e determine a concentração de HCl desconhecida, presente no titulado. R: [NaOH]= 0,1 mol dm-3 VNaOH gasto = 10 mL = 0,01dm3 [HCl]= ? mol dm-3 VHCl = 25 mL = 0,025 dm3 Como estequiometria 1: 1 na= nb Ca Va = Cb Vb Ca 0,025 = 0,1 0,01 Ca = 0,04 mol dm-3 )(2)()()( laqaqaq OHNaClNaOHHCl
- 55. EXERCÍCIO Na titulação de 20,00 cm3 de uma solução de HNO3, gastaram-se 10,00 cm3 de NaOH de concentração 0,10 mol dm-3. a) Completa a equação química que traduz esta titulação ácido-base. b) Calcule a concentração da solução ácida. c) Qual o pH no ponto de equivalência? Justifique. d) Qual o pH da solução após a adição de 4, 00 cm3 de solução de NaOH? (___)(___))()(3 ___________ aqaq NaOHHNO
- 56. EXERCÍCIO R: a) b) Estequiometria 1:1. Resultado: Ca= 0,05 mol dm-3 c) O pH no ponto de equivalência é 7 (a 25 ºC). No ponto de equivalência existe a solução de um sal derivado de um ácido forte e de uma base forte. Como os iões deste sal não sofrem hidrólise, a solução é neutra. d) nb = cb Vb nb = 0,10 4,00 10-3 nb = 4,00 10-4 mol na = ca Va na = 0,05 20,00 10-3 nb = 10 10-4 mol Nesta altura existe excesso de ácido forte de 6 10-4 mol num volume de 24,00 cm3. A sua concentração é 0,025 mol dm-3. Calculo do pH da solução de HNO3, 0,025 mol dm-3. [H3O+]= [HNO3] ionizado= 0,025 mol dm-3 pH = - log [H3O+]= - log (0,025) pH = 1,6 )(3)(3)(2)(3 aqaqlaq OHNOOHHNO
- 59. Existem alguns ácidos fracos que possuem uma certa cor quando na sua forma molecular e uma cor diferente quando estão na forma ionizada. Isso pode ser muito útil, pois dependendo da cor da solução podemos saber se o ácido está ionizado ou não. Mais do que isso, podemos saber a concentração do ião H+ na solução. Por isso dizemos que esses ácidos fracos são indicadores da concentração do ião H+ . Podemos chamar essas substâncias de Indicadores.
