Reações orgânicas: classificação e exemplos
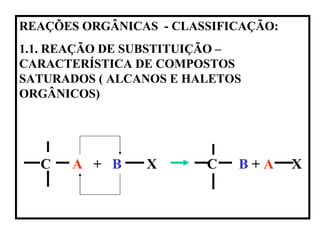
- 1. REAÇÕES ORGÂNICAS - CLASSIFICAÇÃO: 1.1. REAÇÃO DE SUBSTITUIÇÃO – CARACTERÍSTICA DE COMPOSTOS SATURADOS ( ALCANOS E HALETOS ORGÂNICOS) C A + B X C B + A X
- 2. 1.1.1. SUBSTITUIÇÃO EM ALCANOS ( APOLARES SOFREM CISÃO HOMOLÍTICA) SUBSTITUIÇÃO POR RADICAIS LIVRES H H H 3 C C H + Cl Cl H 3 C Cl + H Cl H H
- 3. REAÇÕES DE SUBSTITUIÇÃO CLORAÇÃO H Cl + R H HCl + R Cl BROMAÇÃO R H + Br Br HBr + R Br NITRAÇÃO OH NO 2 + R H R NO 2 + H OH SULFONAÇÃO R H + HO SO 3 H H 2 O + R SO 3 H
- 4. SUBSTITUIÇÃO EM AROMÁTICOS NITRAÇÃO ACILAÇÃO
- 5. ALQUILAÇÃO
- 6. REAÇÕES ORGÂNICAS 1. REAÇÕES DE SUBSTITUIÇÃO. 1.1. ALCANOS: Por serem apolares sofrem cisão homolítica e a reação ocorre por meio de radicais livres. EXEMPLO: Halogenação - Cloração do metano: CH 4 + 4C ℓ 2 C Cℓ 4 + 4HC ℓ
- 7. 1.2.HALETOS ORGÂNICOS - Por serem compostos polares, sofrem cisão heterolítica. Como a molécula orgânica perde o elétron da ligação com o halogênio, é atacada por um reagente nucleófilo. EXEMPLO: Reação com água - Monocloroetano + água. H 3 C- Cl + H OH H 3 C- OH + H Cl
- 8. 1.3.FACILIDADE DE SUBSTITUIÇÃO EM ALCANOS: H LIGADO A C TERCIÁRIO > H LIGADO A C SECUNDÁRIO > H LIGADO A C PRIMÁRIO EXEMPLO: Propano + bromo : produz uma quantidade maior de 2-bromopropano do que de 1- bromopropano. H 3 C-CH 2 -CH 3 + Br 2 H 3 C-CH-CH 3 + HBr Br H 3 C-CH 2 -CH 2 + HBr Br
- 9. 1.4. SUBSTITUIÇÃO NO BENZENO - O benzeno, por possuir ligações pi deslocalizadas é atacado por eletrófilos. 1.4.1 - HALOGENAÇÃO: Reação com cloro em presença de ferro como catalisador: H Cl + Cl – Cl + H Cl
- 10. 1.4.2 - NITRAÇÃO - Reação com ácido nítrico em presença de ácido sulfúrico como catalisador.
- 11. 1 .4.3 - SULFONAÇÃO - Reação com ácido sulfúrico em presença de SO 3 . H + OH SO 3 H SO 3 H + HOH
- 12. 1.4.4 - ACILAÇÃO DE FRIEDEL-CRAFTS - Reação com CLORETO DE ACILA, em presença de AlCl 3.
- 13. 1.4.5 - ACILAÇÃO DE FRIEDEL-CRAFTS - Reação com cloreto de acila, no caso o cloreto de etanoíla, em presença de AlCl 3 H C = O O CH 3 + C-CH 3 HCl + Cl
- 14. 1.4.6 - A substituição em derivados do benzeno é orientada pelo átomo ou grupo de átomos ( diferente de H ) que está ligado ao anel aromático. 1.4.6.1 - RADICAIS ORTO E PARA -DIRIGENTES: AMINA, HIDRÓXI, ALCÓXI (ÉTER), RADICAIS ALQUILA E HALOGÊNIOS. SÃO RADICAIS DE PRIMEIRA CLASSE OU ATIVANTES. CH 3 CH 3 2 ON NO 2 + 3HONO 2 NO 2 +3H 2 O
- 15. 1 .4.6.2- RADICAIS META-DIRIGENTES: NITRO, SULFÔNICO, CARBOXILA, ALDOXILA, CARBONILA, ÉSTER, ACILA E CIANO. SÃO RADICAIS DE SEGUNDA CLASSE OU DESATIVANTES. NO 2 NO 2 + 2Cl-CH 3 H 3 C CH 3 + 2HCl SOP IM SATURADO INSATURADO ORTO-PARA META
- 16. 1.4.7 - Substituição em homólogos do benzenos ( diferem por um ou mais grupos CH 2 ) 1.4.7.1-NO A N EL: N EVE, N UVEM N OITE - EXEMPLO - Cl + tolueno: CH 3 CH 3 Cl Cl + 3 Cl + 3 HCl Cl
- 17. 1.4.7.2 NA CADEIA C ALOR, C LARIDADE, C ADEIA EXEMPLO Cl 2 + tolueno: CH 3 CH 2 Cl + Cl 2 + HCl
- 18. 1 . REAÇÕES DE ADIÇÃO. A B C = C + 3 AB C – C 1.1. - ADIÇÃO EM ALCENOS 2.1.2 - HIDROGENAÇÃO - Eteno + H 2 ( catalisadores: platina, paládio ou níquel) H 2 C = CH 2 + H 2 H 3 C – CH 3
- 19. 2.1.3 - HALOGENAÇÃO - Adição de F 2 , Cl 2 , Br 2 e I 2 na presença de luz. Propeno + Cl 2 Cl Cl H 2 C=C-CH 3 + Cl 2 H 2 C-CH-CH 3
- 20. 2.1.4 - HALETOS DE HIDROGÊNIO - Segue a regra de Markovnikov - O hidrogênio do haleto se liga ao carbono mais hidrogenado da dupla). EXEMPLO: Propeno + HCl : Cl H 2 -C=CH-CH 3 + H Cl H 3 -C-CH-CH 3
- 21. 2.1.5. BROMETO DE HIDROGÊNIO - KHARASCH - A reação em presença de peróxidos inverte a regra de Makovnikov- o hidrogênio liga-se ao carbono menos hidrogenado da dupla. Propeno + HBr: H 2 O 2 H 2 C=C H -CH 3 + H Br H 2 C-C H 2 -CH 3 Na 2 O 2
- 22. 2.1.6 - ÁGUA - A adição de água em alcenos ocorre em meio ácido e obedece à regra de Markonikov. Produz álcoois. EXEMPLO: Eteno + água: MEIO ÁCIDO H 2 C=CH 2 + HOH H 3 C-CH 2 OH
- 23. 1. REAÇÕES DE ADIÇÃO EM CICLANOS. OS CICLANOS COM ATÉ 5 CARBONOS NA MOLÉCULA PODEM SOFRER REAÇÕES DE ADIÇÃO. 1.1. TEORIA DAS TENSÕES DE BAYER - Quanto mais o ângulo entre as ligações no ciclo se afasta de 109 28' mais instável ( e mais fácil de ser rompido) se torna o ciclano. Isto ocorre na ordem: ciclopropano (60 ), ciclobutano (90 ) e ciclopentano (108 ).
- 24. 13.2 EXEMPLOS DE HIDROGENAÇÃO E HALOGENAÇÃO DO: 1.13.2.1. CICLOPROPANO Ni/CALOR + H 2 H 3 C-CH 2 -CH 3 Ni/CALOR + Cl 2 Cl-CH 2 -CH 2 -CH 2 Cl
- 25. 3.2.2. CICLOBUTANO Ni/CALOR + H 2 H 3 C-CH 2 -CH 2 -CH 3 Ni/CALOR + Cl 2 Cl-CH 2 -CH 2 -CH 2 -CH 2 -Cl
- 26. 1.1. 1. CICLOPENTANO + H 2 H 3 C-CH 2 -CH 2 CH 2 -CH 3 Cl + Cl 2
- 27. 1.1 . 1. CICLO-HEXANO NÃO REAGE COM H 2 – ÂNGULO 109 o 28’ (TODOS OS CICLANOS COM MAIS DE 6 CARBONOS) Cl + Cl 2
- 28. 4.REAÇÕES DE ELIMINAÇÃO: 4.1. ELIMINAÇÃO INTRAMOLECULAR DE HALETOS ORGÂNICOS. PRODUZ ALCENOS É FEITA COM KOH EM MEIO ALCOÓLICO. O HIDROGÊNIO MAIS FACILMENTE ELIMINADO: C TERC MAIOR C SEC MAIOR C PRIMÁRIO, O QUE IRÁ DETERMINAR O COMPOSTO OBTIDO EM MAIOR QUANTIDADE.
- 29. EXEMPLO : 2-CLOROPROPANO PRODUZ PROPENO. Cl H 3 C-CH-CH 3 + KOH KCl + HOH + H 2 C=CH 2 -CH 3
- 30. 4.2. ELIMINAÇÃO INTRAMOLECULAR DE ÁLCOOIS. PRODUZ ALCENOS. ÁCIDO SULFÚRICO COMO CATALISADOR E 170 O C. EXEMPLO: ETANOL PRODUZ ETENO H OH H 2 C – CH 2 HOH + H 2 C=CH 2
- 31. 4.3.ELIMINAÇÃO INTERMOLECULAR DE ÁLCOOIS. PRODUZ ÉTERES. PRESENÇA DE ÁCIDO SULFÚRICO E 140 O C . H 3 C-CH 2 - OH + H O-CH 2 -CH 3 HOH + H 3 C-CH 2 -O-CH 2 -CH 3
- 32. 4.4.ELIMINAÇÃO INTERMOLECULAR DE ÁCIDOS CARBOXÍLICOS. PRODUZ ANIDRIDOS. OCORRE NA PRESENÇA DE AGENTES DESIDRATANTES COMO ÁCIDO SULFÚRICO, PENTÓXIDO DE DIFÓSFORO OU ÁCIDO FOSFÓRICO. O O H 3 C-C C-CH 3 HOH + OH H O O O + H 3 C-C - O - C-CH 3
- 33. 5. PRINCIPAIS REAÇÕES ORGÂNICAS ESPECÍFICAS. 5.1. COMBUSTÃO: EXEMPLO COMBUSTÃO DO PROPANO: COMBUSTÃO TOTAL CH 3 -CH 2 -CH 3 + 5O 2 3 CO 2 +4H 2 O COMBUSTÃO PARCIAL CH 3 -CH 2 -CH 3 + 7/2 O 2 3 CO +4 H 2 O COM FORMAÇÃO DE FULIGEM CH 3 -CH 2 -CH 3 + 2 O 2 3 C +4 H 2 O
- 34. 5.2.SALIFICAÇÃO. É A REAÇÃO ENTRE UM ÁCIDO CARBOXÍLICO E UMA BASE DE ARRHENIUS. EXEMPLO: ÁCIDO PALMÍTICO E HIDRÓXIDO DE SÓDIO PRODUZ PALMITATO DE SÓDIO (SABÃO) E ÁGUA. C 15 H 31 COO H + Na OH C 15 H 31 COONa + H 2 O
- 35. 5.3.ESTERIFICAÇÃO - REAÇÃO DE FISCHER . ÁCIDO + ÁLCOOL PRODUZ ÉSTER + ÁGUA (EQUILÍBRIO). EXEMPLO: H 3 C-CO OH + H OCH 2 CH 3 HOH + O + H 3 C-C-O-CH 2 -CH 3
- 36. 5.6.OXIDAÇÃO E REDUÇÃO. OXIDAÇÃO - AÇÃO DO [O]. REDUÇÃO - AÇÃO DO [H]. 5.6.1. OZONÓLISE DE ALCENOS - SE AMBOS OS CARBONOS DA DUPLA SÃO PRIMÁRIOS OU SECUNDÁRIOS PRODUZ ALDEÍDOS. H 2 C = CH-CH 3 + O 3 + H 2 O H-C=O + O=C-CH 3 + H 2 O 2 H H
- 37. 6.2.SE AMBOS OS CARBONOS QUE FAZEM PARTE DA DUPLA SÃO TERCIÁRIOS PRODUZ CETONAS. H 3 C - C = C - CH 2 - CH 3 + O 3 + H 2 O CH 3 CH 3 H 3 C - C = O + O = C - CH 2 - CH 3 + H 2 O 2 CH 3 CH 3
- 38. 6.3.SE UM DOS CARBONOS QUE FAZ PARTE DA DUPLA LIGAÇÃO É PRIMÁRIO OU SECUNDÁRIO E O OUTRO É TERCIÁRIO. H 3 C-C = CH-CH 3 + O 3 + H 2 O CH 3 H 3 C-C = O + O= CH-CH 3 + H 2 O 2 CH 3
- 39. 7.OXIDAÇÃO BRANDA - OCORRE COM PERMANGANATO DE POTÁSSIO EM MEIO BÁSICO. NA OXIDAÇÃO BRANDA, APENAS A LIGAÇÃO PI É ROMPIDA SENDO SUBSTITUÍDA POR LIGAÇÕES SIGMAS FEITAS COM GRUPOS -OH. 7.1. ALCENO PRODUZ DIOL VICINAL. KMnO 4 H 2 C = CH 2 +2[O] H 2 C – CH 2 H 2 O/OH - OH OH
- 40. 7.2.ETINO PRODUZ ETANODIAL KMnO 4 /BÁSICO H-C = C-H + 4[O] O = C – C = O + H H + H 2 O 2
- 41. 7.3. ALCINO COM TRIPLA ENTRE CARBONOS SECUNDÁRIOS PRODUZ DICETONA (DIONA). KMnO 4 /BÁSICO O O H 3 C-C=C-CH 3 + 4[O] H 3 C – C – C - CH 3 + 2 H 2 O.
- 42. 7.4. ALCINO COM TRIPLA ENTRE CARBONOS PRIMÁRIO E SECUNDÁRIO PRODUZ ALDEÍDO-CETONA (FUNÇÃO MISTA). KMnO 4 /BÁSICO O H 3 C-C=CH + 4[O] H 3 C-C-C=O + 2H 2 O H B ásico B randa
- 43. 8. OXIDAÇÃO ENÉRGICA - OCORRE COM PERMANGANATO DE POTÁSSIO EM MEIO ÁCIDO HÁ RUPTURA DA CADEIA. 8.1. DUPLA EM CARBONO PRIMÁRIO. PRODUZ ÁCIDO CARBÔNICO QUE SE DECOMPÕE EM ÁGUA E GÁS CARBÔNICO. H-C = C-H + 6 [O] 2H 2 CO 3 2CO 2 + 2H 2 O E nérgica Á cido
- 44. 8.2. DUPLA EM CARBONO SECUNDÁRIO PRODUZ ÁCIDO CARBOXÍLICO. KMnO 4 /H + H 3 C-C = C-CH 3 + 4[O] 2 H 3 C-COOH
- 45. 8.3. DUPLA EM CARBONO TERCIÀRIO PRODUZ CETONA. KMnO 4 /H + H 3 C - C = C - CH 3 + 2[O] 2H 3 C - C = O CH 3 CH 3 CH 3
- 46. 9. OXIDAÇÃO DE ÁLCOOIS. O DICROMATO DE POTÁSSIO EM MEIO ÁCIDO É MUITO USADO NA OXIDAÇÃO BRANDA DE ÁLCOOIS. 9.1. METANOL - OXIDAÇÃO PARCIAL PRODUZ METANAL E ÁCIDO METANÓICO. A TOTAL PRODUZ GÁS CARBÔNICO E ÁGUA. H 3 C-OH + 3[O] H 2 O + HC=O +[O] H H-COOH H 2 O + CO 2 OXIDAÇÃO DE ÁLCOOIS: K 2 Cr 2 O 7 /H +
- 47. 9.2. ÁLCOOL PRIMÁRIO. PARCIAL PRODUZ ALDEÍDO E TOTAL ÁCIDO CARBOXÍLICO. K 2 Cr 2 O 7 /H + H 3 C-CH 2 OH + [O] H 2 O + H 3 C-C=O H K 2 Cr 2 O 7 /H + H 3 C-C=O + [O] H 3 C-COOH H
- 48. 9.3. ÁLCOOL SECUNDÁRIO. A OXIDAÇÃO TOTAL PRODUZ CETONA. OH K 2 Cr 2 O 7 /H + O H 3 C–C–CH 3 + [O] H 3 C–C–CH 3 + H 2 O
- 49. 9.4. O ÁLCOOL TERCIÁRIO NÃO OXIDA OH H 3 C–C–CH 3 + [O] NÃO REAGE CH 3
- 50. 10.REDUÇÃO DE ÁCIDOS, ALDEÍDOS E CETONAS. OCORRE COM ZINCO EM PRESENÇA DE ÁCIDO CLORÍDRICO . 10.1. ALDEÍDO. REDUÇÃO TOTAL PRODUZ ÁLCOOL PRIMÁRIO H 3 C-C=O + 2[H] H 3 C-CH 2 -OH H
- 51. 10.2. ÁCIDO CARBOXÍLICO. REDUÇÃO PARCIAL PRODUZ ALDEÍDO E TOTAL ÁLCOOL PRIMÁRIO. H 3 C-C=O + 2[H] H 2 O + H 3 C-C=O +2[H] OH H H 3 C-CH 2 -OH
- 52. ÁLCOOL PRIMÁRIO OXIDAÇÃO REDUÇÃO ALDEÍDO OXIDAÇÃO REDUÇÃO ÁCIDO CARBOXÍLICO
- 53. 10.3. CETONA. REDUÇÃO TOTAL PRODUZ ÁLCOOL SECUNDÁRIO. O OH H 3 C-C-CH 3 + 2[H] H 3 C-C-CH 3
- 54. ÁLCOOL SECUNDÁRIO OXIDAÇÃO REDUÇÃO CETONA