Factores que regulan la actividad enzimática
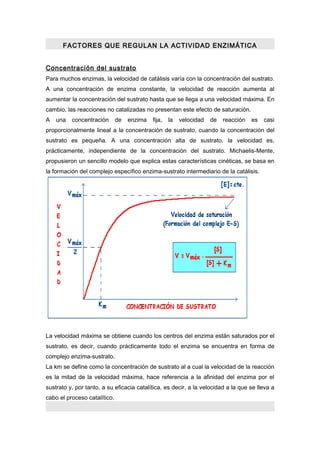
- 1. FACTORES QUE REGULAN LA ACTIVIDAD ENZIMÁTICA Concentración del sustrato Para muchos enzimas, la velocidad de catálisis varía con la concentración del sustrato. A una concentración de enzima constante, la velocidad de reacción aumenta al aumentar la concentración del sustrato hasta que se llega a una velocidad máxima. En cambio, las reacciones no catalizadas no presentan este efecto de saturación. A una concentración de enzima fija, la velocidad de reacción es casi proporcionalmente lineal a la concentración de sustrato, cuando la concentración del sustrato es pequeña. A una concentración alta de sustrato, la velocidad es, prácticamente, independiente de la concentración del sustrato. Michaelis-Mente, propusieron un sencillo modelo que explica estas características cinéticas, se basa en la formación del complejo específico enzima-sustrato intermediario de la catálisis. La velocidad máxima se obtiene cuando los centros del enzima están saturados por el sustrato, es decir, cuando prácticamente todo el enzima se encuentra en forma de complejo enzima-sustrato. La km se define como la concentración de sustrato al a cual la velocidad de la reacción es la mitad de la velocidad máxima, hace referencia a la afinidad del enzima por el sustrato y, por tanto, a su eficacia catalítica, es decir, a la velocidad a la que se lleva a cabo el proceso catalítico.
- 2. Temperatura Al igual que ocurre en la mayoría de las reacciones químicas la velocidad de las reacciones catalizadas por enzimas se incrementa en general con la temperatura, dentro del intervalo en que el enzima es estable y permanece totalmente activo. La velocidad de muchas reacciones enzimáticas se duplica aproximadamente por cada 10ºC que aumenta la temperatura. Como la función enzimática depende de la estructura terciaria (o cuaternaria) la actividad de la enzima puede llegar a desaparecer si se producen cambios notables de temperatura. La mayoría de las enzimas se inactivan a Tª comprendidas entre 50 y 60ºC, excepto las que se encuentran en determinadas bacterias termófilas, capaces de resistir Tª de hasta 80ºC. El descenso de la Tª disminuye la actividad enzimática pero no llega a desnaturalizar las enzimas, así los animales po2quilotermos, que carecen de mecanismos homeostáticos para regular la Tª se ven obligados a hibernar en la estación fría, pues la actividad de sus enzimas queda muy reducida en esa época. Existe una temperatura óptima en que la actividad enzimática es máxima; por encima de ella la actividad disminuye e incluso desaparece por desnaturalización del enzima (en general es un fenómeno que ocurre en todas las proteínas).
- 3. pH Cuando todos los demás factores permanecen constantes, la velocidad de las reacciones enzimáticas depende del ph del medio. Pequeñas variaciones del pH del medio interno ocasionan grandes cambios en la actividad de las enzimas, pues se modifican las cargas superficiales y se altera la conformación espacial de la estructura terciaria o cuaternaria. Todas las enzimas poseen una zona de pH, en la que alcanza su máxima velocidad, las enzimas como proteínas responden a los cambios de pH, tienen grupos disociables y el grado de disociación que presentan está relacionado con las propiedades catalíticas. A medida que el pH cambia, las cargas de los diferentes aminoácidos se modifican y lo mismo sucede con la forma de la enzima, hasta que se altera tanto que deja de funcionar; lo más importante sería que las cargas del centro activo y del sustrato cambian de manera que afecta la capacidad de fijación. El pH ejerce una acción parecida a la de la Tª y existe, por tanto, también un ph óptimo tal que, ala alejarse de él, disminuye la actividad enzimática. El pH es diferente para los distintos enzimas de un organismo y así la pepsina del estómago está adaptada aun pH ácido, mientras que la tripsina o la quimotripsina del intestino están adaptadas a un pH ligeramente alcalino.
- 4. Inhibidores Determinadas sustancias se comportan como inhibidores enzimáticos, porque disminuyen e incluso anulan la velocidad de la reacción catalizada. Estas sustancias pueden ser varios tipos: a) Inhibición irreversible.- Es este tipo de inhibición la enzima se une con el inhibidor covalentemente de manera que se modifica el centro activo de la enzima necesario para la catálisis. Estos inhibidores son compuestos que se unen irreversiblemente a determinados grupos del centro activo de una enzima y anulan su capacidad catalítica. Ejemplo el cianuro (citocromo oxidasa), gases nerviosos e insecticidas organofosforados, inhiben la acetilcolinesterasa, enzima implicada en la transmisión del impulso nervioso ocasionando parálisis o muerte.
- 5. b) Inhibición reversible.- Cuando no se inutiliza el centro activo de la enzima, sino que se dificulta la acción de éstos, disminuyendo su eficacia. Podemos diferenciar dos tipos atendiendo a su mecanismo de actuación. b1. Inhibición competitiva.- La característica es que el inhibidor puede combinarse con el enzima libre de tal modo que compite con el sustrato normal para unirse al centro activo. Mientras el enzima tenga unido un inhibidor no puede formarse el complejo enzima-sustrato y, por tanto, la reacción no se da. Como la unión no es irreversible, un descenso en la concentración del inhibidor o un aumento en la del sustrato permiten el desplazamiento del inhibidor.
- 6. b2. Inhibición no competitiva. El inhibidor puede unirse a la enzima en un lugar distinto al centro activo, provocando un descenso de la velocidad pero no impide la unión ES. Un inhibidor no competitivo puede combinarse con el enzima libre o bien con el complejo ES, interfiriendo en la acción de ambos. Los inhibidores no competitivos se unen al centro del enzima distinto del centro activo, a menudo para deformar al enzima, de modo que no puede formarse el complejo ES a su velocidad normal y que una vez formado no se descomponen a su velocidad habitual para liberar los productos de reacción.
- 7. Activadores
- 8. Fuente: Editorial Bruño- Educastur