Ligações Químicas: Iônicas e Covalentes
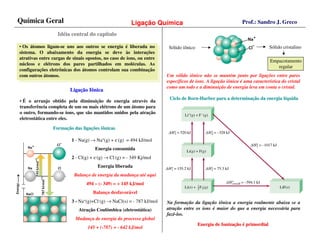
- 1. Química Geral Prof.: Sandro J. Greco Ligação Química Idéia central do capítulo Idé capí • Os átomos ligam-se uns aos outros se energia é liberada no Sólido cristalino Sólido iônico sistema. O abaixamento da energia se deve às interações atrativas entre cargas de sinais opostos, no caso de íons, ou entre Empacotamento núcleos e elétrons dos pares partilhados em moléculas. As regular configurações eletrônicas dos átomos controlam sua combinação com outros átomos. Um sólido iônico não se mantém junto por ligações entre pares específicos de íons. A ligação iônica é uma característica do cristal como um todo e a diminuição de energia leva em conta o cristal. Ligação Iônica Ligaç Ciclo de Born-Harber para a determinação da energia líquida Born- determinaç lí • É o arranjo obtido pela diminuição de energia através da transferência completa de um ou mais elétrons de um átomo para o outro, formando-se íons, que são mantidos unidos pela atração eletrostática entre eles. Formação das ligações iônicas Formaç ligaç 1 - Na(g) → Na+(g) + e-(g) = 494 kJ/mol Energia consumida 2 - Cl(g) + e-(g) → Cl-(g) = - 349 Kj/mol Energia liberada Balanço de energia da mudança até aqui 494 – (- 349) = + 145 kJ/mol Balanço desfavorável 3 - Na+(g)+Cl-(g) → NaCl(s) = - 787 kJ/mol Na formação da ligação iônica a energia realmente abaixa se a atração entre os íons é maior do que a energia necessária para Atração Coulômbica (eletrostática) fazê-los. Mudança de energia do processo global Energia de Ionização é primordial Ionizaç 145 + (-787) = - 642 kJ/mol
- 2. Química Geral Prof.: Sandro J. Greco Ligação Química Mudança de energia potencial quando um sólido se forma Mudanç só Modelo simples de um sólido unidimensional só Imagine uma linha longa de cátions e ânions alternados com espaçamento regular, cujos centros estão separados pela distância d, a soma dos raios iônicos. • Se as cargas dos íons têm o mesmo valor absoluto (+1 e -1, +2 e -2, por exemplo), então z1 = +z, z2 = -z e z1z2 = - z2, então: Interações entre íons – Energia potencial de Coulomb Interaç (- z2e2 + z2e2 – z2e2 + z2e2 - ...) Ep1,2 = 1 x A energia da rede cristalina do sólido, isto é, a diferença entre a 4πε0r12 d 2d 3d 4d energia dos íons empacotados de um sólido e os íons muito πε afastados de um gás é expressa quantitativamente pela equação mostrada a seguir que relaciona a força da interação com as cargas dos íons e seus raios. Ep1,2 = z2e2 (1- 1/2 + 1/3 – 1/4+ ...) = z2e2 x ln 2 e2 Ep1,2 = (z1e) x (z2e) = z1z2 onde: 4πε0r12 4πε0r12 πε πε 4πε0r12 4πε0r12 πε πε • Por fim multiplicamos Ep por dois para obter a energia resultante das interações de ambos os lados do íon central e a • e = carga elementar, isto é, o valor absoluto da carga de um elétron seguir pela constante de avogrado, NA, para obter a expressão de e = 1,602 x 10-19 C energia de rede por mol de íons. • z1 e z2 = número de cargas sobre os íons (cátion e ânion); Ep1,2 = -2 ln 2 x z2 NA e2 • r12 = distância entre os centros dos íons; 4πε0r12 πε • εo = permissividade do vácuo = 8,854 x 10-12 J-1.C2.m-1
- 3. Química Geral Prof.: Sandro J. Greco Ligação Química Modelo estendido a um arranjo tridimensional Ep1,2 = -A x /z1 z2/ NA e2 onde: 4πε0r12 πε • A = constante numérica positiva chamada de constante de Mamelung, cujo valor depende do arranjo dos íons. Conseqüências das interações Coulômbicas Conseqü interaç Sólidos com altos pontos de fusão e quebradiços Conclusões Ep1,2 = -A x /z1 z2/ NA e2 4πε0r12 πε A energia potencial é muito negativa para valores elevados de z (íons com cargas elevadas) e para valores pequenos de d (pequena separação de cargas). Energia repulsiva – Equação de Born-Meyer Equaç Born- Ep min.= - /z1 z2/ NA e2 x (1 – d*/d) A 4πε0r12 πε EP* ∝ e –d/d* d* = constante = 34,5 pm
- 4. Química Geral Prof.: Sandro J. Greco Ligação Química • No bloco d, as energias dos orbitais (n-1)d são inferiores do que Osso humano os orbitais ns. Assim, os elétrons s são perdidos em primeiro lugar, seguindo-se um número variável de elétrons (n-1)d. Fe – [Ar]3d6 4s2 → Fe3+ - [Ar]3d5 Não-Metais Configurações eletrônicas dos íons Configuraç Metais • Os não-metais raramente perdem elétrons em reações químicas porque suas energias de ionização são muito elevadas. Entretanto, eles podem adquirir elétrons suficientes para completar a sua camada de valência e formar o octeto correspondente à configuração do gás nobre posterior. • Quando um átomo de um metal do bloco s forma um cátion, ele perde um ou mais elétrons até atingir a estrutura de gás nobre de seu caroço – octeto de elétrons. Na – [Ne]3s1 → Na+ - [He]2s2 2p6 = Ne
- 5. Química Geral Prof.: Sandro J. Greco Ligação Química Double bond – two atoms share two pairs of electrons Ligação Covalente Ligaç A proposta de Lewis para explicar a ligação entre dois átomos de OCO or O O C não-metais é que um par de elétrons é compartilhado pelos dois double bonds 8e- 8e- 8e- átomos, isto é, os elétrons interagem com os dois núcleos. Triple bond – two atoms share three pairs of electrons NN or N N 8e-8e- triple bond Escrevendo estruturas de Lewis Estruturas de Lewis • Escreva os átomos que estão ligados entre si na molécula. Coloque como átomo central o átomo de menor energia de • Os átomos compartilham elétrons até atingir a configuração de ionização; um gás nobre – Regra do Octeto: Na formação de uma ligação covalente, os átomos tendem a completar seus octetos pelo • Arranjar os átomos simetricamente em torno do átomo central. compartilhamento de elétrons. Exceção é o óxido nitroso – NNO e não NON; • Escreva o átomo central primeiro e em seguida os átomos + F F FF ligados a eles, completando um octeto para todos os átomos, 7e- 7e- 8e- 8e- exceto para o átomo de hidrogênio; • Conte o número total de elétrons de valência e adicione um Lewis structure of F2 elétron para cada carga negativa e subtraia um para cada carga positiva; F lone pairs F lone pairs single covalent bond • Se a estrutura contém elétrons em excesso, forme quantas duplas single covalent bond ou triplas ligações no átomo central forem necessários. FF lone pairs lone pairs Lewis structure of water + O+ H HOH or H H H O 2e- -2e- 8e
- 6. Química Geral Prof.: Sandro J. Greco Ligação Química Write the Lewis structure of nitrogen trifluoride (NF3). Ressonância Step 1 – N is less electronegative than F, put N in center Step 2 – Count valence electrons N - 5 (2s22p3) and F - 7 (2s22p5) 5 + (3 x 7) = 26 valence electrons Step 3 – Draw single bonds between N and F atoms and complete octets on N and F atoms. Step 4 - Check, are # of e- in structure equal to number of valence e- ? 3 single bonds (3x2) + 10 lone pairs (10x2) = 26 valence electrons F N F F 9.6 Write the Lewis structure of the carbonate ion (CO32-). Step 1 – C is less electronegative than O, put C in center Step 2 – Count valence electrons C - 4 (2s22p2) and O - 6 (2s22p4) -2 charge – 2e- 4 + (3 x 6) + 2 = 24 valence electrons Step 3 – Draw single bonds between C and O atoms and complete octet on C and O atoms. Step 4 - Check, are # of e- in structure equal to number of valence e- ? 3 single bonds (3x2) + 10 lone pairs (10x2) = 26 valence electrons Step 5 - Too many electrons, form double bond and re-check # of e- 2 single bonds (2x2) = 4 1 double bond = 4 O C O 8 lone pairs (8x2) = 16 Total = 24 O 9.6
- 7. Química Geral Prof.: Sandro J. Greco Ligação Química Carga Formal • A carga formal de um átomo em uma dada estrutura de Lewis é a carga que ele teria se as ligações fossem perfeitamente covalentes e o átomo tivesse exatamente a metade dos elétrons compartilhados das ligações. Carga formal = V – (L + ½ S), onde: • V = número de elétrons de valência do átomo livre; • L = número de elétrons presentes nos pares isolados; • S = número de elétrons compartilhados Carga formal = no de elétrons que um átomo possui na molécula Serve para predizer o arranjo mais favorável favorá dos átomos em uma molécula molé H Formaldeído ou H C O H C O H
- 8. Química Geral Prof.: Sandro J. Greco Ligação Química -1 +1 Exceções a regra do octeto Exceç C – 4 e- 2 single bonds (2x2) = 4 O – 6 e- 1 double bond = 4 H C O H 2H – 2x1 e- Octetos incompletos 2 lone pairs (2x2) = 4 12 e- Total = 12 Be – 2e- 2H – 2x1e- BeH2 H Be H formal charge total number 4e- total number total number 1 ( ) on an atom in of valence electrons in - - = of nonbonding of bonding a Lewis 2 electrons electrons structure the free atom B – 3e- 3 single bonds (3x2) = 6 formal charge F B F 3F – 3x7e- = 4 -2 -½ x 6 = -1 BF3 9 lone pairs (9x2) = 18 on C Total = 24 24e- F formal charge = 6 -2 -½ x 6 = +1 on O 0 0 C – 4 e- 2 single bonds (2x2) = 4 H 9.7 O – 6 e- 1 double bond = 4 C O H 2H – 2x1 e- 2 lone pairs (2x2) = 4 F tem alta energia 12 e- Total = 12 de ionização formal charge total number total number total number 1 ( ) on an atom in of valence - of nonbonding - = of bonding a Lewis electrons in 2 electrons electrons structure the free atom Ligação covalente coordenada formal charge = 4 - 0 -½ x 8 = 0 on C formal charge = 6 -4 -½ x 4 = 0 on O 9.7
- 9. Química Geral Prof.: Sandro J. Greco Ligação Química Ligações Iônicas versus Ligações Covalentes Ligaç Ligaç Camadas de valência expandidas As ligações iônicas e covalentes são dois modelos extremos de Átomo central com número quântico principal n > 2 ligações químicas. A maior parte das ligações reais têm caráter duplo, parte iônica, parte covalente. F F F 6e- S– Correção do modelo covalente: Eletronegatividade Correç 6 single bonds (6x2) = 12 6F – 42e- SF6 S 18 lone pairs (18x2) = 36 Total = 48 48e- F F F H-Cl ↔ H+ Cl- ↔ H- Cl+ Ligação covalente polar • Em 1932 Linus Pauling propôs uma medida quantitativa da distribuição dos elétrons nas ligações. O poder de atração dos Moléculas com número ímpar de elétrons de valência elétrons exercido por um átomo que participa de uma ligação é chamado de eletronegatividade. Radicais e birradicais • Pauling baseou sua escala de eletronegatividade nas energias de dissociação D das ligações A-A, B-B e A-B. 5e- N– O – 6e- NO N O 11e- / ΧA – ΧB / = 0,102 {D(A-B) – ½ [D(A-A) + D(B-B)]}1/2 O modelo de Lewis não prevê o caráter de birradicais das moléculas
- 10. Química Geral Prof.: Sandro J. Greco Ligação Química • Robert Mulliken desenvolveu um modelo mais simples, onde em Correção do modelo iônico: Polarizabilidade Correç seu modelo a eletronegatividade é a média entre a energia de • Todas as ligações iônicas tem algum caráter de ligação ionização e a afinidade eletrônica do elemento, ambas expressas em covalente. Como as cargas positivas do cátion atraem os elétrons eletronvolts. do ânion, a nuvem eletrônica esférica do ânion distorce-se em direção ao ânion. Essa distorção pode ser interpretada como χ = ½ (I + Eae) sendo uma tendência do par de elétrons de deslocar-se para a região internuclear e formar uma ligação covalente. Os átomos e íons que se distorcem facilmente são chamados de muito polarizáveis, como por exemplo o I-; Os átomos e íons capazes de provocar grandes distorções na nuvem eletrônica dos átomos vizinhos tem alto poder de polarização, como por exemplo o Al+3. Relações Diagonais
- 11. Química Geral Prof.: Sandro J. Greco Ligação Química Força e Comprimento das ligações covalentes Forç ligaç As características de uma ligação covalente entre dois átomos são devidas principalmente às propriedades desses átomos. Força de ligação Forç ligaç • A força de uma ligação química é medida por sua energia de dissociação D, que é a energia necessária para separar os átomos ligados. Quanto maior a energia de dissociação, maior a força da ligação A energia da ligação cresce quando a multiplicidade da ligação aumenta (C-C, C=C), decresce quando aumenta o números de elétrons não ligantes em átomos vizinhos (H-H e F-F) e decresce com o aumento da raio atômico (H-F, H-Cl, H-Br e H-I).
- 12. Química Geral Prof.: Sandro J. Greco Ligação Química Variação do raio covalente Variaç Comprimento de ligação ligaç • O comprimento de ligação é a distância entre os centros de dois em ligação covalente e corresponde à distância internuclear no mínimo de energia potencial dos dois átomos. O raio covalente de um átomo é a contribuição que ele dá para o comprimento de uma ligação covalente.
