Evolução Modelos Atômicos
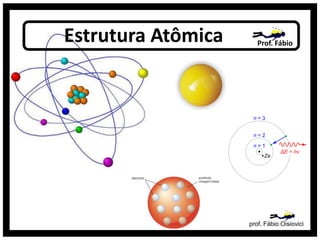
- 1. Estrutura Atômica Prof. Fábio prof. Fábio Oisiovici
- 2. Demócrito ( 460 – 370 aC ) Filósofo grego • Tentava explicar de que eram feitas as “coisas” (matéria) • Tudo era feito de átomos e de espaços vazios • Os átomos eram indivisíveis e eternos • Os átomos apresentavam diferentes tamanhos, formatos, massa, etc. • Os líquidos eram constituídos por átomos arredondados, já os metais por átomos pontiagudos. prof. Fábio Oisiovici
- 3. Dalton ( 1810 ) • Modelo com base em experiências • Primeiro a associar átomos a estequiometria prof. Fábio Oisiovici
- 4. A Teoria de Dalton A matéria é feita de átomos individuais Cada elemento é feito de átomos idênticos e únicos Átomos são imutáveis Elementos podem se combinar para formar compostos diferentes
- 5. O átomo de Dalton maciço indivisível incriável indestrutível homogêneo
- 6. J. J. Thomson ( 1898 ) • Descobre os elétrons 1891 • Experiências com Raios Catódicos prof. Fábio Oisiovici
- 7. J. J. Thomson ( 1898 ) • Os raios catódicos são constituídos por pequenas partículas de carga negativa – os elétrons • Os átomos não são indivisíveis, pois partículas eletricamente carregadas podem ser arrancadas deles através da ação de forças elétricas, radiação ultravioleta ou calor • A massa dos elétrons é pelo menos mil vezes menor do que a de um átomo de hidrogênio ( O valor atual é de 1837 vezes menor ) prof. Fábio Oisiovici
- 8. O átomo de Thomson • A eletricidade e o magnetismo, vistos até então como fenômenos macroscópicos, passam a ter uma importância fundamental na descrição das propriedades dos átomos e das moléculas • São elas as forças que regem todas as ligações químicas e dão à matéria as suas propriedades
- 9. Rutherford ( 1911 ) • A experiência de Rutherford • Átomo Planetário prof. Fábio Oisiovici
- 10. A Experiência de Rutherford Rutherford bombardeou uma lâmina fina de ouro com partículas alfa(carga positiva) prof. Fábio Oisiovici
- 11. A Experiência de Rutherford • A maioria dos raios passa direto pelas placas de metal; • Algumas partículas sofrem desvio em uma das placas de ouro; • Pouquíssimas partículas são rebatidas. prof. Fábio Oisiovici
- 12. O Átomo de Rutherford • Núcleo muito denso e com carga positiva • Espaços vazios • Elétrons girando em torno do núcleo em uma região denominada eletrosfera prof. Fábio Oisiovici
- 13. Bohr( 1913 ) • Camadas Eletrônicas • Energia Quantizada fogos de artifício prof. Fábio Oisiovici
- 14. O Átomo de Bohr( 1913 ) No estado fundamental de um átomo, os elétrons se encontram girando em torno do núcleo em um certo nível de energia. Se os elétrons de um átomo recebem um quantum de energia, eles saltam para níveis mais externos. Neste caso, dizemos que os elétrons entram em estado excitado. Quando os elétrons liberam o quantum de energia, eles saltam para níveis mais internos e a energia liberada pelos elétrons sai em forma, principalmente, de quantum de luz ou fóton. prof. Fábio Oisiovici
- 15. O Átomo de Bohr( 1913 ) O modelo atômico de Bohr explica a luz emitida por: fogos de lâmpadas artifício fluorescentes prof. Fábio Oisiovici
- 16. Comparando : indivisível elétron núcleo camada Gregos X Dalton X Thomson X Rutherford X X Bohr X X X prof. Fábio Oisiovici
- 17. Diagrama de Pauling Os elétrons estão distribuídos no átomo em subníveis e em ordem crescente de energia prof. Fábio Oisiovici
- 18. Diagrama de Pauling Faça a distribuição em subníveis e em níveis 12Mg: prof. Fábio Oisiovici
- 19. Diagrama de Pauling Faça a distribuição em subníveis e em níveis 12 Mg:1s2, 2s2, 2p6,3s2 K:2 L:8 M:2 prof. Fábio Oisiovici
- 20. Diagrama de Pauling Faça a distribuição em subníveis e em níveis 23V: prof. Fábio Oisiovici
- 21. Diagrama de Pauling Faça a distribuição em subníveis e em níveis 23 V:1s2, 2s2, 2p6,3s2, 3p6, 4s2,3d3 K:2 L:8 M:11 N:2 prof. Fábio Oisiovici
- 22. Diagrama de Pauling Faça a distribuição em subníveis e em níveis 23 V3+: prof. Fábio Oisiovici
- 23. Diagrama de Pauling Faça a distribuição em subníveis e em níveis 23 V3+:1s2, 2s2, 2p6,3s2, 3p6,3d2 K:2 L:8 M:11 N:2 10 Os elétrons são retirados da última camada prof. Fábio Oisiovici
- 24. Treinamento 01. prof. Fábio Oisiovici
- 25. Treinamento 01. prof. Fábio Oisiovici
- 26. Treinamento 02. prof. Fábio Oisiovici
- 27. Treinamento 02. prof. Fábio Oisiovici
- 28. Treinamento 03. prof. Fábio Oisiovici
- 29. Treinamento 03. prof. Fábio Oisiovici
- 30. Treinamento 04. prof. Fábio Oisiovici
- 31. Treinamento 04. prof. Fábio Oisiovici
- 32. Treinamento 05. prof. Fábio Oisiovici
- 33. Treinamento 05. prof. Fábio Oisiovici
- 34. Treinamento 06. prof. Fábio Oisiovici
- 35. Treinamento 06. prof. Fábio Oisiovici
- 36. Treinamento 07. prof. Fábio Oisiovici
- 37. Treinamento 07. v v F v v prof. Fábio Oisiovici
- 38. Treinamento 08. prof. Fábio Oisiovici
- 39. Treinamento 08. prof. Fábio Oisiovici
- 40. Treinamento 08. prof. Fábio Oisiovici
- 41. Treinamento 09. prof. Fábio Oisiovici
- 42. Treinamento 09. prof. Fábio Oisiovici
- 43. Treinamento 10. prof. Fábio Oisiovici
- 44. Treinamento 10. prof. Fábio Oisiovici
- 45. Treinamento 11. prof. Fábio Oisiovici
- 46. Treinamento 11. prof. Fábio Oisiovici
- 47. Treinamento 12. Julgue as proposições a seguir como V ou F A descoberta dos elétrons, no início do século XX, ocorreu durante a famosa experiência da lâmina de ouro, realizada por Ernest Rutherford.( ) Os feixes de elétrons utilizados em microscópios eletrônicos, para iluminar as amostras em análise, têm a mesma natureza dos raios catódicos.( ) O modelo atômico proposto por Rutherford foi comparado ao sistema planetário.( ) A noção de partículas atômicas eletricamente carregadas surge nas Ciências Naturais somente após a proposição do modelo atômico de J. Thomson.( ) prof. Fábio Oisiovici
- 48. Treinamento 12. Julgue as proposições a seguir como V ou F A descoberta dos elétrons, no início do século XX, ocorreu durante a famosa experiência da lâmina de ouro, realizada por Ernest Rutherford.( ) F Os feixes de elétrons utilizados em microscópios eletrônicos, para iluminar as amostras em análise, têm a mesma natureza dos raios catódicos.( ) V O modelo atômico proposto por Rutherford foi comparado ao sistema planetário.( ) V A noção de partículas atômicas eletricamente carregadas surge nas Ciências Naturais somente após a proposição do modelo atômico de J. Thomson.( ) F prof. Fábio Oisiovici
- 49. Treinamento 12. Julgue as proposições a seguir como V ou F O modelo atômico proposto por Ernest Rutherford, em 1911, tem como característica uma intensa e uniforme dispersão das partículas subatômicas no interior do átomo.( ) Os átomos têm a capacidade de emitir luz no exato momento em que elétrons saltam de camadas mais internas para outras mais externas da eletrosfera atômica.( ) A diferença de cor da luz emitida por lâmpadas de mercúrio e por lâmpadas de sódio, utilizadas na iluminação pública, independe da cor que esses metais apresentam quando no estado sólido. ( ) O espalhamento de partículas α produzido por uma fina folha de ouro possibilitou a Rutherford reconhecer que o núcleo atômico é muito pequeno e de alta densidade, contendo todas as cargas positivas do átomo. ( ) prof. Fábio Oisiovici
- 50. Treinamento 12. Julgue as proposições a seguir como V ou F O modelo atômico proposto por Ernest Rutherford, em 1911, tem como característica uma intensa e uniforme dispersão das partículas subatômicas no interior do átomo.( ) F Os átomos têm a capacidade de emitir luz no exato momento em que elétrons saltam de camadas mais internas para outras mais externas da eletrosfera atômica.( ) F A diferença de cor da luz emitida por lâmpadas de mercúrio e por lâmpadas de sódio, utilizadas na iluminação pública, independe da cor que esses metais apresentam quando no estado sólido. V ( ) O espalhamento de partículas α produzido por uma fina folha de ouro possibilitou a Rutherford reconhecer que o núcleo atômico é muito pequeno e de alta densidade, contendo todas as cargas positivas do átomo. ( ) V prof. Fábio Oisiovici
- 51. Treinamento 12. Julgue as proposições a seguir como V ou F O íon 33As5+ que é produzido durante a mineração do manganês e que contamina os lençóis freáticos da Região Amazônica tem, na eletrosfera, 38 elétrons.( ) O cálcio e o potássio, presentes no acarajé, apresentam o mesmo número de camadas eletrônicas, e os seus íons, 20Ca 2+ e 19K+, são isoeletrônicos do18Ar.( ) Um elemento químico é identificado pelo seu número de massa.( ) As novas tecnologias utilizadas em microscópios possibilitaram a visão do núcleo atômico, confirmando as previsões de Dalton feitas no século XIX. ( ) Os elétrons dos átomos dos elementos químicos, quando excitados, liberam energia que neutraliza a carga nuclear( ) prof. Fábio Oisiovici
- 52. Treinamento 12. Julgue as proposições a seguir como V ou F O íon 33As5+ que é produzido durante a mineração do manganês e que contamina os lençóis freáticos da Região Amazônica tem, na eletrosfera, 38 elétrons.( ) F O cálcio e o potássio, presentes no acarajé, apresentam o mesmo número de camadas eletrônicas, e os seus íons, 20Ca 2+ e 19K+, são isoeletrônicos do18Ar.( ) V Um elemento químico é identificado pelo seu número de massa.( ) F As novas tecnologias utilizadas em microscópios possibilitaram a visão do núcleo atômico, confirmando as previsões de Dalton feitas no século XIX. ( ) F Os elétrons dos átomos dos elementos químicos, quando excitados, liberam energia que neutraliza a carga nuclear( ) F prof. Fábio Oisiovici
- 54. Treinamento
- 55. O modelo atômico proposto por J. J. Thomson, em 1904, supunha que o átomo, de forma esférica,seria constituído por um tipo de fluido com carga positiva, com os elétrons uniformemente distribuídos nele, de modo a equilibrar a carga positiva. Esse modelo ficou conhecido como pudim de passas, as passas fazendo o papel dos elétrons e o pudim, o das cargas positivas distribuídas uniformemente. Em 1911, Ernest Rutherford propôs um modelo alternativo para o átomo, com base nos resultados dos experimentos, realizados sob sua supervisão, de H. Geiger e E. Marsden, que consistia em bombardear uma fina folha de ouro com partículas alfa (núcleos de átomos de hélio). De acordo com o modelo de Thomson, esperava-se que não houvessem desvios significativos dessas partículas já que previa uma distribuição uniforme da carga positiva no volume do átomo. Os resultados obtidos mostraram que a maior parte das partículas passava sem se desviar, porém uma pequena parte era desviada sob grandes ângulos, o que só seria possível se fossem desviadas por um alvo massivo de carga positiva. Baseado nos resultados desse experimento, E. Rutherford propôs um modelo atômico no qual a carga positiva, e também a maior parte da massa do átomo, estaria concentrada em uma pequena região, o núcleo. Por sua vez, os elétrons, estariam distribuídos em órbitas ao redor desse núcleo. De acordo com esse modelo, a maior parte do espaço ocupado pelo átomo é vazia de modo que a maioria das partículas consegue atravessar a lâmina com pouco ou nenhum desvio. Entretanto aquelas que incidem diretamente sobre o núcleo sofrem desvios sob grandes ângulos, ocorrendo inclusive desvios sob ângulos maiores do que 90º. O experimento de Rutherford foi de grande importância para o estabelecimento do modelo atômico atualmente aceito, sendo essa a sua grande repercussão.
- 56. Treinamento 14. BAHIANA DE MEDICINA Mencione duas diferenças entre os modelos atômicos de J. Dalton e de E. Rutherford.
- 57. Treinamento 14. BAHIANA DE MEDICINA Dalton afirmava que o átomo era maciço e indivisível, já Rutherford dizia que o átomo era constituído basicamente por espaços vazios, logo não era maciço, e que poderia ser dividido em duas regiões: núcleo e eletrosfera.
- 58. Treinamento 15. BAHIANA DE MEDICINA Escreva a distribuição eletrônica do íon 2+ 30Zn
- 59. Treinamento 15. BAHIANA DE MEDICINA Escreva a distribuição eletrônica do íon 2+ 30Zn 1s2 2s2 2p6 3s2 3p6 4s0 3d10 , em ordem crescente de energia e 2-8-18 em camadas
- 60. 2012.1 . ( ) O átomo de tungstênio, 74W184, apresenta, no seu núcleo, uma maior quantidade de prótons que de nêutrons
- 61. 2012.1 . ( ) O átomo de tungstênio, 74W184, apresenta, no seuF núcleo, uma maior quantidade de prótons que de nêutrons
- 62. 2011.2 . ( ) O átomo de cromo-41 é isóbaro do átomo de sódio-24 e apresenta o dobro do número de nêutrons do átomo desse elemento químico.
- 63. 2011.2 . ( ) O átomo de cromo-41 é isóbaro do átomo de sódio-24 e apresenta o dobro do número de nêutrons do átomo desse elemento químico. F
- 64. 2011.1 . ( ) O tecnécio, 43Tc99, apresenta 99 partículas no núcleo atômico, e o iodo, 53I131, tem 53 prótons.
- 65. 2011.1 . ( ) O tecnécio, 43Tc99, apresenta 99 partículas no núcleo atômico, e o iodo, 53I131, tem 53 prótons. V
- 66. 2012.2 . ( ) O Zn2+ reflete a radiação ultravioleta que incide sobre a pele porque apresenta configuração eletrônica [ Ar ] 4s23d10
- 67. 2012.2 . ( ) O Zn2+ reflete a radiação ultravioleta que incide sobre a pele porque apresenta configuração eletrônica [ Ar ] 4s23d10 F
