Resumen de reaccones redox
•Télécharger en tant que PPTX, PDF•
1 j'aime•522 vues
Este documento describe diferentes métodos para disolver precipitados, incluyendo la formación de un ácido o base débil, la formación de un complejo estable, o un proceso redox. También explica cómo realizar diluciones y calcular la riqueza y cantidad necesaria de un soluto comercial para preparar una disolución de concentración específica.
Signaler
Partager
Signaler
Partager
Recommandé
Contenu connexe
Tendances
Tendances (20)
Determinación vitamina c en un preparado farmacéutico sandra castro

Determinación vitamina c en un preparado farmacéutico sandra castro
Práctica 03 - Ley de la Conservación de la Materia

Práctica 03 - Ley de la Conservación de la Materia
Problemas propuestos de preparacion de disoluciones por diluciones sucesivas

Problemas propuestos de preparacion de disoluciones por diluciones sucesivas
Práctica 7. Determinación de cloruros en agua de río

Práctica 7. Determinación de cloruros en agua de río
En vedette (6)
Similaire à Resumen de reaccones redox
Similaire à Resumen de reaccones redox (20)
Cap6 problemasbalancedemateriaensistemasnoreaccionantes sol

Cap6 problemasbalancedemateriaensistemasnoreaccionantes sol
Práctica 2. Titulación ácido-base Córdoba Kattia.pdf

Práctica 2. Titulación ácido-base Córdoba Kattia.pdf
Plus de David Córdova
Plus de David Córdova (11)
Resumen de reaccones redox
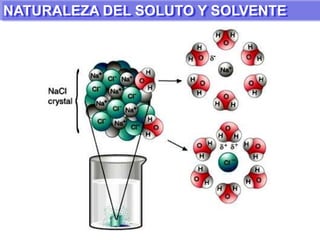
- 1. NATURALEZA DEL SOLUTO Y SOLVENTE
- 2. • Disminución de las concentraciones de uno de los iones (S ): 1. Formación de un a.d.: precipitados con aniones aportados por a.d. se disuelven en a.f. 2. Formación de una b.d.: eliminar concentración de iones de OH 3. Formación de un complejo estable: K inest > Kps 4. Mediante un proceso redox: cambio de numero de oxidación:
- 3. • Uno de los iones que forman parte del precipitado experimentan oxidación o reducción, disminuyendo su concentración en solución.
- 5. • INDICADORES: - Específicos : se oxidan / se reducen - Generales (reales): dependen del Eº del sistema
- 6. DILUCIONES Se realizan en el matraz aforado con una pipeta Factor de dilución (fd): nº de veces en que se diluye
- 7. 7 Riqueza () • Las sustancias que se usan en el laboratorio suelen contener impurezas. • Para preparar una disolución se necesita saber qué cantidad de soluto puro se añade. • msustancia (pura) = ——————————— · 100 msustancia (comercial) De donde : • 100 msust. (comercial) = msust. (pura) · ——
- 8. 8 Ejemplo: ¿Como prepararías 100 ml de una disolución 0’15 M de NaOH en agua a partir de NaOH comercial del 95 % de riqueza? m = Molaridad · M(NaOH) · V m = 0’15 mol/l · 40 g/mol · 0’1 l = 0’60 g de NaOH puro 100 mNaOH (comercial) = mNaOH (pura) · —— = 100 = 0’60 g · —— = 0’63 g NaOH comercial 95
- 9. 9 Ejercicio: Prepara 250 cm3 de una disolución de HCl 2 M, sabiendo que el frasco de HCl tiene las siguientes indicaciones: d=1,18 g/cm3; riqueza = 35 % • m = Molaridad · M(HCl) · V • m = 2 mol/l · 36,5 g/mol · 0’25 l = 18,3 g de HCl puro que equivalen a • 100 18,3 g ·—— = 52,3 g de HCl comercial 35 • m 52,3 g V = — = ————— = 44,3 cm3 d 1,18 g/cm3
- 10. RECUERDE : • 1cc = 1 ml • 1cc= 20 gotas • 1cc = 60 microgotas • 1 litro = 1000 ml • 1gramo (g) = 1.000 miligramos (mg) • 20 gotas = 60 microgotas • 1 mg = 1.000 microgramos (µg)
