Redox-Reacciones
- 10. ABUNDANCIA RELATIVA DE ELEMENTOS
- 11. Electroquímica Rama de la química que estudia la interconversión entre la energía eléctrica y la energía química. Trata del uso De las reacciones químicas para producir electricidad (pila) De la electricidad para producir reacciones químicas (electrólisis)
- 12. Estudio sistemático de las reacciones Redox Hay dos formas de proceder al montaje de una reacción REDOX
- 13. LA FEM DEPENDE DE NATURALEZA DE LOS ELECTRODOS CONCENTRACIÓN DE LOS IONES TEMPERATURA QUE OPERA LA CELDA NOTACIÓN CONVENCIONAL / DIAGRAMA DE LA CELDA Zn(s)/Zn +2 (ac,1M)/KCl(saturado)/Cu +2 (ac,1M)/Cu(s) POR CONVENCIÓN ÁNODO A LA IZQUIERDA.
- 14. POTENCIALES ESTANDAR DEL ELECTRODO LA FEM MEDIDA EN UNA CELDA ES LA SUMA DE LOS POTENCIALES ELÉCTRICOS. EN CONDICIONES DE ESTADO ESTANDAR (P H 2 =1 atm y [C] disol =1 M y a 25ºC), EL º = 0 V 2H + (ac,1M) + 2e - H 2 (g,1atm) º = 0 V º = POTENCIAL ESTANDAR DE REDUCCIÓN
- 15. Li + (ac) + e - Li(s) º = - 3,05 V 2H + (ac) + 2e - H 2 (g) º= 0,00 V F 2 (g) + 2e - 2F - (ac) º = +2,87 V PODER OXIDANTE CRECIENTE POR CONVENCIÓN POTENCIALES ESTANDAR DE REDUCCIÓN DE LAS SEMI-REACCIONES. PODER REDUCTOR CRECIENTE
- 16. EFECTO DE LA CONCENTRACIÓN DE LA CELDA EC. DE NERNST = º - 0,0591 Log K n SI EL VALOR DE K <1 Log = -1 > º
- 17. PROBLEMA CALCULE LA FEM QUE GENERA LA CELDA CUYAS SEMI-REACCIONES SON LAS SIGUIENTES Cr 2 O 7 -2 Cr +3 Eº = 1,36 V I - I 2 Eº= - 0,54 V CUANDO [Cr 2 O 7 -2 ] = 2,0 M [Cr +3 ] = 1,0 X 10 -5 M [ I - ] = 1,0 M [ H + ] = 1,0 M
- 18. 1.- Reacciones redox 2.- Termodinámica de sistemas electroquímicos Pilas galvánicas 3.- Fuerza electromotriz de las pilas Potenciales de electrodo. 4.- Dependencia de la fem con las concentraciones Ecuación de Nernst 5.- Tipos de electrodos 6.- Aplicación: pilas y baterías 7.- Corrosión
- 19. REACCIONES REDOX Reacción de oxidación-reducción: Aquella en la que ocurre una transferencia de electrones. Zn + Cu 2+ Zn 2+ + Cu Semirreacción de oxidación Zn pierde electrones: se oxida; es el agente reductor Semirreacción de reducción Cu 2+ gana electrones: se reduce; es el agente oxidante Zn Zn 2+ + 2e - Cu 2+ + 2e - Cu Intervienen dos pares redox conjugados Zn 2+ /Zn Cu 2+ /Cu
- 20. Ca Ca +2 + 2e - O 2 + 4e - 2O -2 2Ca 2Ca +2 + 4e - O 2 + 4e - 2O -2 X 2 2Ca + O 2 2Ca +2 + 2O -2 SEMIRREACCIÓN PÉRDIDA DE e - = Rx. OXIDACIÓN Ca SE OXIDA: ACTÚA COMO AGENTE REDUCTOR SEMIRREACCIÓN GANANCIA DE e - = Rx. REDUCCIÓN O2 SE REDUCE: ACTÚA COMO AGENTE OXIDANTE
- 21. Mediante los estados de oxidación A cada elemento se le asigna un estado de oxidación: Una reacción será redox si hay cambios en dichos estados. CO + ½ O 2 CO 2 CO + ½ O 2 CO 2 ¿Cómo poner de manifiesto la transferencia electrónica? 0 -2 -2 +2 +4 Ventajas Proporciona un mecanismo para reconocer reacciones redox Ayuda a ajustar reacciones redox
- 22. EN LAS REACCIONES REDOX LOS NÚMEROS DE OXIDACIÓN AYUDAN A LLEVAR UN SEGUIMIENTO DE LA DISTRIBUCIÓN DE CARGA Y SE ASIGNAN A TODOS LOS ÁTOMOS DE UN COMPUESTO O DE UN ION DE ACUERDO CON REGLAS ESPECÍFICAS. OXIDACIÓN AUMENTO EN EL NÚMERO DE OXIDACIÓN. REDUCCIÓN DISMINUCIÓN EN EL NÚMERO DE OXIDACIÓN
- 23. NÚMERO O ESTADO DE OXIDACIÓN TODO ÁTOMO QUE FORMA PARTE DE UNA MOLÉCULA ESTÁ CARACTERIZADO POR UN ESTADO DE OXIDACIÓN, QUE SE EXPRESA MEDIANTE UN NÚMERO ENTERO, POSITIVO O NEGATIVO. REGLAS EL ESTADO DE OXIDACIÓN DE TODO ELEMENTO LIBRE ES 0. EN SUS COMPUESTOS, EL H PRESENTA SIEMPRE EL ESTADO DE OXIDACIÓN +1 (EXCEPTO EN HIDRUROS) EN SUS COMPUESTOS EL O PRESENTA EL ESTADO DE OXIDACIÓN –2. LA SUMA TOTAL DE LOS ESTADOS DE OXIDACIÓN DE LOS ÁTOMOS QUE CONSTITUYEN UNA MOLÉCULA DEBE SER 0. LA SUMA DE LOS ESTADOS DE OXIDACIÓN DE LOS ÁTOMOS QUE CONSTITUYEN UN IÓN ES IGUAL A LA CARGA RESULTANTE DEL IÓN.
- 24. TERMODINÁMICA DE SISTEMAS ELECTROQUÍMICOS Sistemas electroquímicos: Aquéllos en los que ocurren reacciones de transferencia de electrones. Zn + Cu 2+ Zn 2+ + Cu Zn 2+ Reacción por contacto directo. Así no es un dispositivo útil para generar corriente eléctrica. Pila electroquímica : Dispositivo en el que se produce una corriente eléctrica (flujo de e - a través de un circuito) gracias a una reacción espontánea (pila galvánica o voltaica) o en que se utiliza corriente eléctrica para llevar a cabo una reacción química no espontánea (célula electrolítica) . Zn Cu 2+ SO 4 2- Cu
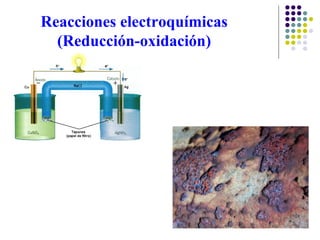
- 25. ELECTROQUÍMICA SE BASA EN PROCESOS REDOX DISPOSITIVO EXPERIMENTAL ELECTRICIDAD CELDA ELECTROQUÍMICA Zn(s) + Cu +2 Zn +2 + Cu
- 26. LAS RXS DE SEMI-CELDA : ELECTRODO DE Zn (ANODO)-OXIDACIÓN. Zn(s) Zn +2 (ac) + 2e - ELECTRODO DE Cu (CÁTODO)-REDUCCIÓN Cu +2 + 2e - Cu (s) e - KCl ZnSO 4 CuSO 4 ANIONES SO 4 -2 ;Cl - ÁNODO CATIONES Zn +2 ;Cu +2 ;K + CÁTODO LOS ELECTRONES FLUYEN DEL ÁNODO AL CATODO Zn(s) + Cu +2 Zn +2 + Cu
- 27. LOS e - FLUYEN DE UN ELECTRODO A OTRO UNA DIFERENCIA DE POTENCIAL ENTRE LOS 2 ELECTRODOS. FUERZA ELECTROMOTRIZ (Fem ó (VOLTS)) (VOLTAJE DE LA CELDA O POTENCIAL DE LA CELDA)
- 28. Luigi Galvani (1737-1798) Alessandro Giuseppe Antonio Anastasio Volta (1745-1827)
- 29. Zn (s) | Zn 2+ (1 M) || Cu 2+ (1 M) | Cu(s) Pila Daniell John Frederic Daniell (1790-1845) Zn Zn 2+ + 2e - Oxidación Cu 2+ + 2e - Cu Reducción (-) (+)
- 30. FUERZA ELECTROMOTRIZ DE LAS PILAS. POTENCIALES DE ELECTRODO La corriente eléctrica fluye debido a una diferencia de potencial entre los dos electrodos, llamada fuerza electromotriz (fem, ). Unidades: voltios (V) G = W elec = q Fuerza impulsora G G = n F (-) (+) q = n F ; F = 96485 C mol -1
- 33. Se tabulan potenciales estándar ( º) de reducción Serie electroquímica A mayor º, mayor tendencia a reducirse tiene la especie oxidada del par redox (más oxidante es). La fem de una pila se calcula como: º = º(cátodo) º(ánodo) Para que funcione la pila (reacción espontánea): º > 0 p.ej.: 0.34 – ( 0.76) = 1.10 V p.ej.: Zn 2+ + 2e - Zn º = 0.76 V Cu 2+ + 2e - Cu º = +0.34 V Más tendencia a reducirse; más oxidante [reducción] [oxidación]
- 34. DEPENDENCIA DE LA FEM CON LAS CONCENTRACIONES. ECUACIÓN DE NERNST Si las condiciones no son estándar ¿cuánto vale la fem? G = Gº + RT ln Q G = n F Gº = n F º n F n F º + RT ln Q Ecuación de Nernst A 25ºC :
- 35. [ http://www.nobel.se/chemistry/laureates/19 20 /index.html ] Walther Hermann Nernst (1864-1941) “ En reconocimiento a su trabajo en termoquímica”. 1920 Premio Nobel de Química
- 36. Otras aplicaciones de la ecuación de Nernst - Obtención de constantes de equilibrio de reacciones redox - Obtención de º en condiciones no estándar En el equilibrio: = 0 y Q = K eq
- 37. - Determinación de productos de solubilidad Se usa cuando se conocen los potenciales de dos semirreacciones que combinadas dan el equilibrio de solubilidad buscado. AgCl (s) + 1e - Ag (s) + Cl - (aq) º = 0.222 V Ag + (aq) + 1e - Ag (s) º = 0.799 V AgCl (s) + 1e - Ag (s) + Cl - (aq) Ag (s) Ag + (aq) + 1e - AgCl (s) Ag + (aq) + Cl - (aq) º = 0.222-0.799 = 0.577 V
- 39. APLICACIÓN: PILAS Y BATERÍAS Pila seca Batería de plomo Pila de botón Batería de níquel-cadmio Células de combustible Baterías primarias. Baterías secundarias. Baterías de flujo y células de combustible. Baterías Ejemplos
- 40. CORROSIÓN ¿En qué consiste? ¿Cuáles son las semirreacciones implicadas? ¿Qué reacciones posteriores originan la herrumbre? ¿Cómo afecta el pH? ¿Cómo se puede prevenir? - Recubrimientos - Galvanizado - Protección catódica