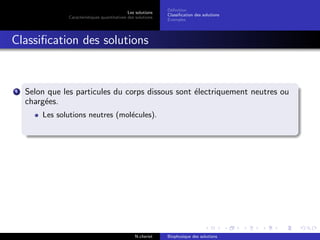
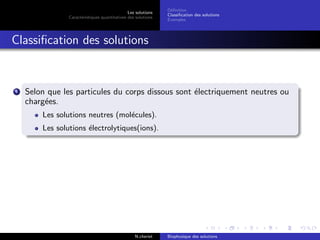
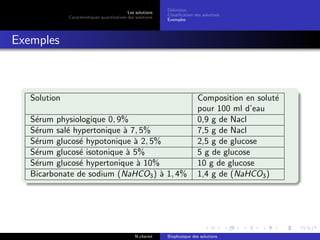
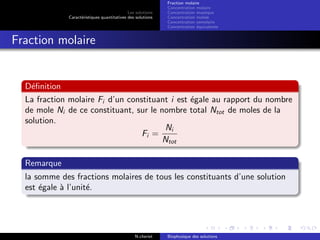
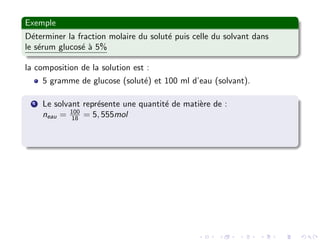
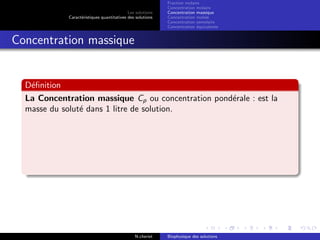
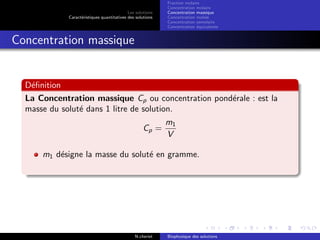
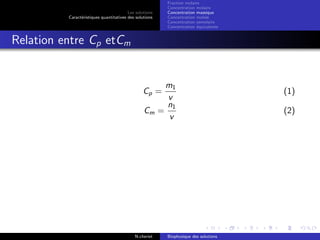
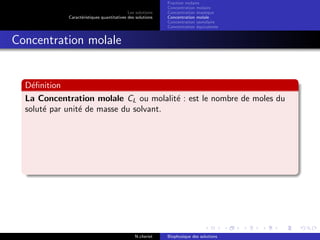
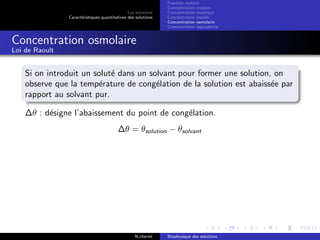
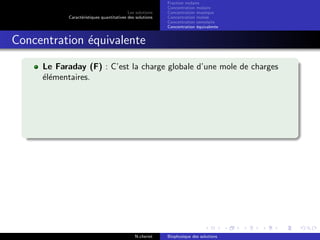
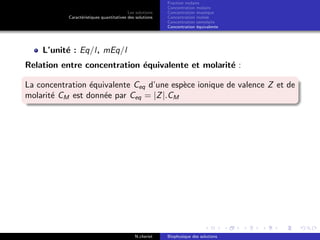
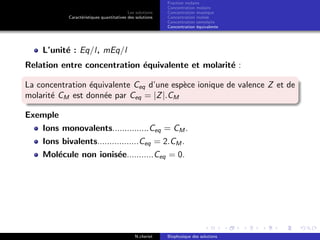
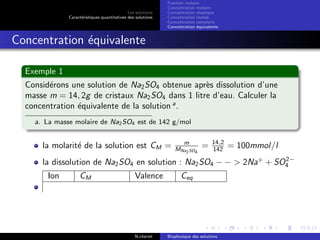
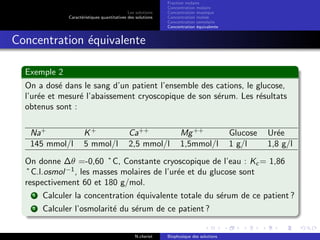
Le document explore les caractéristiques quantitatives des solutions en biophysique, définissant les solutions comme des mélanges homogènes de deux ou plusieurs constituants, avec un solvant majoritaire et un ou plusieurs solutés. Il décrit diverses classifications des solutions basées sur des critères tels que l'électrification des particules et la taille des particules, tout en abordant les concepts de fraction molaire et de différentes concentrations. Des exemples pratiques de solutions et de leurs compositions, comme le sérum glucosé, illustrent les calculs de fraction molaire et de concentration.