аром. кислоты
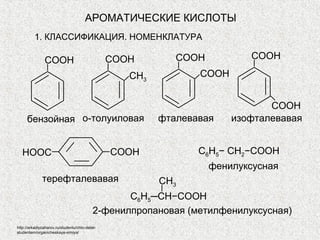
- 1. АРОМАТИЧЕСКИЕ КИСЛОТЫ 1. КЛАССИФИКАЦИЯ. НОМЕНКЛАТУРА СООН СООН СООН СООН СН3 СООН СООН бензойная о-толуиловая фталевавая изофталевавая НООС СООН С6Н5− СН2−СООН фенилуксусная терефталевавая СН3 С6Н5─СН−СООН 2-фенилпропановая (метилфенилуксусная) http://arkadiyzaharov.ru/studentu/chto-delat- studentam/organicheskaya-ximiya/
- 2. 2. ПОЛУЧЕНИЕ АРОМАТИЧЕСКИХ КИСЛОТ 2.1 Окисление алкильных групп гомологов бензола: [O] C6H6 – CH3 C6H5 – COOH + H2O толуол бензойная кислота 2.2 Окисление ароматических кетонов, получаемых по реакции Фриделя – Крафтса. NaOH C6H6–CO–CH3+ 4NaOCl C6H5COOH + 4NaCl + H2O + CO2
- 3. 2. ПОЛУЧЕНИЕ АРОМАТИЧЕСКИХ КИСЛОТ 2.3 Гидролиз тригалогенпроизводных с галогенами у одного углеродного атома: Cl2,hν H2О CH3 CH3 CООH ОН- 2.4 Гидролиз нитрилов: H+ C H COOH + NH + 6 5 4 C6H5–CN + 2H2O OН- C H –COO- + NH 6 5 3
- 4. 2. ПОЛУЧЕНИЕ АРОМАТИЧЕСКИХ КИСЛОТ 2.5 Реакции металлоорганических соединений с CO2: СО2 C6H5– Br + 2Li C6H5 – Li C6H5 – COOLi – LiBr Обычно используют литий- или магнийорганические соединения.
- 5. 3. ФИЗИЧЕСКИЕ СВОЙСТВА • Монокарбоновые кислоты ряда бензола − бесцветные кристалпические вещества с темпер. плавления выше 100 оС. • Они кипят при более высокой и плавятся при значительно более высокой температуре, чем кислоты жирного ряда с тем же числом углеродных атомов. • Кислоты с пара-положением заместителей плавятся при значительно более высокой температуре, чем их изомеры. Почему? • Монокарбоновые кислоты довольно плохо растворяются в холодной воде и значительно лучше в горячей.
- 6. 4. ХИМИЧЕСКИЕ СВОЙСТВА АРОМ. КИСЛОТ Ароматические кислоты вступают во все те реакции, кото- рые, свойственны и кислотам жирного ряда. 4.1 Получение солей. Кислотные свойства C6H5– COOН + NaOH = C6H5– COO-Na+ + H2O C6H5COOН + NaHCO3 = C6H5COO-Na+ + H2O + CO2↑ В водных растворах монокарбоновые кислоты обнаруживают большую степень диссоциации, чем кислоты жирного ряда: О О C−ОH C−О− + H+; Ка = 6,6•10−5 СH3– COOН CH3– COO- + H+ ; Ка = 1,8•10−5
- 7. Влияние заместителей (R) в кольце на кислотность COOH COOֿ + H+ R R Константы диссоциации (105•К) некоторых замещенных бензойных кислот в воде при 25 ْС Положение Заместитель R заместителя R Н СН3 ОСН3 F Cl NO2 Орто 6,27 12,3 8,06 54,1 11,4 671 Мета 6,27 5,35 8,17 13,6 14,8 32,1 пара 6,27 4,24 3,38 7,22 10,5 37,0
- 8. 4. ХИМИЧЕСКИЕ СВОЙСТВА АРОМ. КИСЛОТ 4.2 Получение производных кислот 1. Нагреванием смеси кислоты и спирта в присутствии минеральной (обычно H2SO4) кислоты получают эфиры: O C6H5– COOН + HO–C2H5 C6H5−C−OC2H5+ H2O Наличие заместителей в орто – положении к СООН – группе сильно затрудняет этерификацию. 2. Действием на кислоты хлористого тионила или PCl5 получают хлорангидриды: O C6H5–COOН + SOCl2 C6H5−C−Cl + HCl + SO2
- 9. 4. ХИМИЧЕСКИЕ СВОЙСТВА АРОМ. КИСЛОТ 4.2 Получение производных кислот 3. При действии хлорангидридов на соли получают ангидриды: O O O + - C6H5−C−O−C−C6H5 + NaCl C6H5−C−Cl + NaOOCC6H5 хлористый бензоат ангидрид бензойной бензоил натрия кислоты 4. При действии хлористого бензоила на пероксид натрия получается криталлическая перекись бензоила; приме- няемая как инициатор полимеризации: O O O C6H5−C−Cl + Na2O2 C6H5−C−O−O−C−C6H5 + 2NaCl
- 10. 4. ХИМИЧЕСКИЕ СВОЙСТВА АРОМ. КИСЛОТ 5. Декарбоксилирование: а) Сплавление солей к. кислот со шелочами сплавление Ar – COONa + NaОН ArH + Na2CO3 б) Реакция Хунсдиккера O O O − + Br2 −C−OBr •• −C−O• −C−OAg •• CCl4 −(•Br) Br − CO2 Br2 •
- 11. II. РЕАКЦИИ ПО БЕНЗОЛЬНОМУ КОЛЬЦУ В реакциях электрофильного замещения карбоксильная группа ведет себя как заместитель 2-го рода. Так при хлорировании и нитровании бензойной кислоты полу-чаются главным образом м-хлорбензойная и м- нитробензой-ная кислоты. СООН СООН Сl2 + HСl H Сl СООН СООН HNO3 + H2O H NO2 Вместо прямого хлорирования лучше использовать синтез по реакции Зандмейера…
- 12. МНОГООСНОВНЫЕ АРОМАТИЧЕСКИЕ КИСЛОТЫ СООН СООН СООН НООС СООН СООН терефталевавая фталевавая изофталевавая Способы получения: Двухосновные кислоты получают теми же методами, что и одноосновные, только здесь подвергаются превращению две группы или два атома, например: СН3 СООН СН3 СООН СН3 СООН СООН [О] [О] а) б) СН3
- 13. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА • Многоосновные кислоты – кристаллические вещества с высокой температурой плавления. Двухосновные кислоты плохо растворимы в воде, особенно терефталевая (Как это можно объяснить?). • По химическим свойствам двухосновные кислоты принци- пиально не отличаются от одноосновных. Производные этих кислот – соли, эфиры, амиды, нитрилы – могут быть получены как за счет одной, так и двух карбоксильных групп. • Кислоты с карбоксильными группами в орто-положении, например фталевая кислота. Отличаются от других изомеров способностью легко образовывать ангидриды и др. цикличес-кие производные: О О СООН С С t C o NH3 О NH СООН - H 2O - H2O С С О О
- 14. ПРИМЕНЕНИЕ АРОМАТИЧЕСКИХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ СООН Бензойная кислота. Применяется в производстве красителей, душистых веществ, в качестве консервиру- ющего средства в пищевой промы- Т.пл. 121,5 ْС. шленности. СОCl Хлористый бензоил. Жидкость c характерным запахом и сильным лакриматорным действием. Исполь- зуется как бензоилирующий агент. СН2СООН Фенилуксусная кислота (т. пл. 76 оС). Получается из хлористого бензила. Кислота и её эфиры применяются в парфюрмерии.
- 15. ПРИМЕНЕНИЕ АРОМАТИЧЕСКИХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ СООН Салициловая кислота (т. пл. 76 оС). Получают из фенолята натрия ОН действием СО2 под давлением. Кислота и её эфиры встречаются в природе. Применяется в медицине и анилинокрасочной промышленности. СООН Ацетилсалициловая кислота ОСОСН3 (аспирин) - жаропонижающее средство. СООС6Н5 Фениловый эфир салициловой ОН кислоты (салол) – средство, дезинфицирующее кишечник.
- 16. ПРИМЕНЕНИЕ АРОМАТИЧЕСКИХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ СООН Фталевая кислота применяется в технике, главным образом, в виде фталевого ангидрида для производ- СООН ства метилового этилового, бутило- вого и высших алкильных эфиров, СО которые применяются как пласти- О фикаторы синтетических полимеров СО (особенно поливинилхлорида). СООСН3 Диметиловый эфир фталевой кислоты (диметилфталат) является эффектив- СООСН3 ным репеллентом
- 17. ГЛИФТАЛЕВАЯ СМОЛА Конденсацией фталевого ангидрида с глицерином получают глифталь – полиэфирная смола. OН СО ОН − −СО СООСН2−СН−СН2О− − n∙ О + n∙НОСН2−СН−СН2ОН СО глицерин n плавкая смола −СО СООСН2−СН−СН2О− O СО СО +n/2∙ О СО СО O −СО СООСН2−СН−СН2О− n/2 неплавкая смола
- 18. ПРИМЕНЕНИЕ АРОМАТИЧЕСКИХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ Терефталевая кислота используется в производстве лавсана (терилена, дакрона): окись металла n∙ НООС СООН + n∙HO–CH2–CH2–OH ~200˚С О О −О−С С−О−СН2−СН2− + nH2O n
- 19. вставки СООН O OH H
