Syror och baser grunder
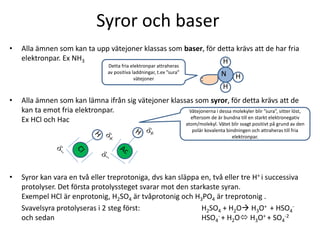
- 1. Syror och baser • Alla ämnen som kan ta upp vätejoner klassas som baser, för detta krävs att de har fria elektronpar. Ex NH3 • Alla ämnen som kan lämna ifrån sig vätejoner klassas som syror, för detta krävs att de kan ta emot fria elektronpar. Ex HCl och Hac • Syror kan vara en två eller treprotoniga, dvs kan släppa en, två eller tre H+ i successiva protolyser. Det första protolyssteget svarar mot den starkaste syran. Exempel HCl är enprotonig, H2SO4 är tvåprotonig och H3PO4 är treprotonig . Svavelsyra protolyseras i 2 steg först: H2SO4 + H2O H3O+ + HSO4 - och sedan HSO4 - + H2O H3O+ + SO4 -2 H N H H: Detta fria elektronpar attraheras av positiva laddningar, t.ex ”sura” vätejoner Vätejonerna i dessa molekyler blir ”sura”, sitter löst, eftersom de är bundna till en starkt elektronegativ atom/molekyl. Vätet blir svagt positivt på grund av den polär kovalenta bindningen och attraheras till fria elektronpar.
- 2. Starka och svaga syror/baser • Alla syror och baser reagerar med vatten i en så kallad protolysreaktion, där en H+ överförs från syran till basen. • Starka syror/baser protolyseras fullständigt, medan svaga syror/baser endast protolyseras delvis. • Protolysgraden anger hur stor andel av syran/basen som protolyserats • En vattenlösning av en stark syra eller bas kommer alltid på grund av protolysgraden att ha en högre koncentration av vätejoner eller hydroxidjoner än vad en vattenlösning av en svag syra eller bas med samma koncentration får. • Starka syror lämnar alla sina H+ i protolysen och vill inte ha tillbaks dem. • Svaga syror lämnar endast en del av sina H+ i protolysen och tar gärna tillbaka dem, i en motsatt protolys. • Starka baser tar emot så många H+ de kan i protolysen och släpper dem inte. • Svaga baser tar endast emot en del av H+ i protolysen och lämnar gärna iväg dem igen.
- 3. Syra- basparDet kan aldrig ske en syrareaktion utan att ett annat ämne reagerar som en bas. När ett ämne lämnar en proton (reagerar som en syra) kommer det att omvandlas till ett ämne som kan ta upp en proton (reagerar som en bas). Ex: HCl + H2O H3O+ + Cl- Här är HCl en syra, kan lämna H+ Vatten är här en bas , kan ta emot en H+ H3O+ är en syra, kan lämna H+ Kloridjonen är här en bas, kan ta emot en H+ Ex: NH3 + H2O NH4 + +OH- Vatten är här en syra , kan lämna en H+ Här NH3 + är en bas, kan ta emot en H+ Hydroxidjonen är en bas, kan ta emot en H+ Ammoniumjonen är en syra, kan lämna H+ Man säger att: Vatten och oxoniumjoner utgör ett korresponderande syra-baspar. Vatten och hydroxidjoner utgör ett annat korresponderande syra-baspar. Saltsyran och kloridjonen utgör ett korresponderande syra-baspar. Ammoniak och ammoniumjonen utgör ett korresponderande syra-baspar. Ju starkare den ena delen i ett syra-baspar är ju svagare blir den korresponderande delen. Ex: Saltsyra är en stark syra eftersom den när den protolyseras bildar den mycket svaga basen Cl- ,kloridjonen är en svag bas för att jonen är mycket stabil i vatten, mkt få ämnen kan ta elektroner ifrån kloridjoner. (klor har hög e-neg) Vissa ämnen kan vara både syra och bas som t.ex vatten dessa ämnen kallas amfolyter och kan reagera med sig själv, detta kallas autoprotolys
- 4. Syra- och bas-konstanter Ka och Kb För varje protolysreaktion kan man skriva en jämviktsekvation. När man gör detta så bakar man in vatten koncentrationen i konstanten som då betecknas Ka eller Kb I övrigt skrivs ekvationen på samma sätt som den generella jämviktsekvationen. Storleken på Ka och Kb ger en indikation på hur stark syran eller basen är.
- 5. Protolys av en stark syra d- d+ H Cl H O H d+ d+ : : d- H H O H : : + + Cl - + I saltsyran kommer den polär kovalenta bindningen mellan väte och klor att ge väteatomen en svagt positiv laddning. I vattnet använder syret 2 elektronpar till att binda 2 st väteatomer och har två fria (obundna) elektronpar. Ett av de fria elektronparen på syret i vattnet attraheras av den svaga positiva laddningen på vätet i saltsyran. När denna attraktion sker kommer det elektronpar som delats mellan väte och klor att överföras helt till kloret som då bildar en negativ kloridjon Väteatomen har nu överförts till vattnet och bildat en positiv oxoniumjon (H3O+) Den positiva laddningen uppstår eftersom syret nu har ”förlorat” ett av sina fria elektronpar och därmed har ett elektronunderskott Den negativa kloridjonen är mycket stabil i vattenlösning och kommer därför inte att reagera med de i vattnet närvarande oxoniumjonerna (H3O+). Reaktionen (protolysen) av HCl i vatten kommer endast att ske i en riktning, då det inte finns någon drivkraft för reaktionen tillbaka. (Kloridjonen är så stabil) O H H H O H H + Cl - I en vattenlösning av en stark syra finns efter protolysen endast oxoniumjoner (H3O+), den negativa jon som bildas när vätet lämnar syran och vatten
- 6. Protolys av en svag syra d- d+ H Ac H O H d+ d+ : : d- H H O H : : + + Ac - + I ättikssyran kommer den polär kovalenta bindningen mellan väte och acetatjonen att ge väteatomen en svagt positiv laddning. I vattnet använder syret 2 elektronpar till att binda 2 st väteatomer och har två fria (obundna) elektronpar. Ett av de fria elektronparen på syret i vattnet attraheras av den svaga positiva laddningen på vätet i ättikssyran. När denna attraktion sker kommer det elektronpar som delats mellan väte och acetat att överföras helt till acetatet som då bildar en negativ acetatjon. Väteatomen har nu överförts till vattnet och bildat en positiv oxoniumjon (H3O+) Den positiva laddningen uppstår eftersom syret nu har ”förlorat” ett av sina fria elektronpar och därmed har ett elektronunderskott Den negativa acetatjonen är inte särkilt stabil i vattenlösning och kommer därför att reagera med de i vattnet närvarande oxoniumjonerna (H3O+). Reaktionen (protolysen) av HAc i vatten kommer därför att ske i båda riktningar. En svag syra protolyseras endast delvis eftersom några av de bildade acetatjonerna kommer att reagera tillbaka och bilda ättikssyra och vatten igen. O H H H O H H + Ac - I en vattenlösning av en svag syra finns efter protolysen oxoniumjoner (H3O+), den negativa jon som bildas när vätet lämnar syran, den ursprungliga syran och vatten, detta eftersom protolysen sker i båda riktningar. AcH
- 7. Protolys av en svag bas H N H H: O H H d+ d+ : : d- H H N H H: + H N H H: O H H d+ d+ : : d- O H : : - H H N H H: + I en vattenlösning av en svag bas finns efter protolysen hydroxidjoner (OH-), den positiva jon (ex NH4 +) som bildas när vätet tas upp av basen, den ursprungliga basen (ex NH3)och vatten. Detta eftersom protolysen sker i båda riktningar samtidigt (se ovan) Vattnet hålls samman av polär kovalenta bindningar som ger en laddnings- förskjutning, där vätet blir svagt positivt I ammoniak finns ett fritt elektronpar som attraheras till vätet i vattnet Av vattnet bildas nu en negativ hydroxidjon O H : : - : Av ammoniaken bildas nu en positiv ammoniumjon Det extra vätet i ammoniumjonen, sitter ganska löst bundet till kvävet, vilket innebär att ammoniumjonen kan fungera som en protongivare (syra), elektronparet återgår då till kväveatomen Ett av de fria elektronparen i hydroxidjonen attraheras av det positiva vätet på ammoniumjonen, vilket leder till en återbildning av vatten och ammoniak O H H O H - H N H H : H N H H :H + Vattnet och ammoniaken kan nu återigen reagera med varandra och bilda hydroxidjoner och ammoniumjoner Väteatomen släpper elektronparet, som övergår helt till syret
- 8. Autoprotolys av vatten Det vill säga vattens syrabas reaktion med sig själv O H : : - d+ d+ d- d+ d- d+ Ett av de fria elektronparen på hydroxidjonen attraheras till ett av de positiva vätena på oxoniumjonen H3O+ Elektronparet mellan vätet och syret överförs i samband med detta helt till syret. Två vattenmolekyler bildas då O H : : - De fria elektronparen på vattnet dras till den det positiva vätet på en annan vattenmolekyl När vätet lämnar den ena vattenmolekylen för att binda till den andra övergår elektronparet helt till syret Då bildas en oxoniumjon (+) och hydroxidjon (-) Oxoniumjonen och hydroxidjonen är starka syror och baser som lätt reagerar med varandraReaktionen mellan först vatten som syra och bas och sedan oxoniumjon och hydroxidjon sker kontinuerligt. I rent vatten är alltid koncentrationen OH- = koncentrationen H3O+
- 9. O H : : - Neutralisation av syra med bas Fullständig formel för neutraliseringen: HCl + NaOH H2O + Na+ + Cl- Eftersom HCl och NaOH är starka syror och baser, kommer de i vattenlösning vara fullständigt protolyserade, dvs de har sönderdelats till H3O+ och OH- . Natriumjonen och kloridjonen kommer inte att delta i reaktionen. (de är åskådarjoner) Ett av de fria elektronparen på hydroxidjonen attraheras till ett av de positiva vätena på oxoniumjonen H3O+ Elektronparet mellan vätet och syret överförs i samband med detta helt till syret. Två vattenmolekyler bildas då Neutralisation innebär att man tillsätter exakt lika stor substansmängd bas som man har syra. Då förbrukas samtliga oxoniumjoner och hydroxidjoner. Kvar blir då vatten, som kommer att färga t.ex BTB grön. Genom att hålla reda på mängden bas man tillsatt kan man bestämma substansmängden syra i ett känt prov.
- 10. Syra-bas titrering •När man titrerar något genomför man en kontrollerad tillsats av ett reagens till en lösning innehållande det ämne man vill bestämma halten av. Tillsats av reagens sker till dess att ekvivalent mängd reagens tillsatts. Man använder sig ofta av någon sorts indikator för att se när detta skett. Den lösning som vi känner V och C för skall alltid finnas i byretten och den okända lösningen i E-kolven. •En syrabas-titrering bygger alltid oavsett bas och syra på neutraliseringsreaktionen som visades tidigare. Vid ekvivalenspunkten gäller för en syra-bas titrering att: n(titrand) = n(titer) •I en syrabas titrering tillsätter man antingen en bestämd volym bas med känd koncentration till en bestämd volym syra med okänd koncentration, eller en bestämd volym syra med känd koncentration till en bestämd volym bas med okänd koncentration. •Ekvivalenspunkten indikeras genom att en syrabasindikator (t.ex BTB) ändrar färg från syra eller basfärgen till den neutrala färgen. I byretten fylls det kända reagenset (titrand) man kan då enkelt läsa av volymen när ekvivalens uppnåtts. Man vet då också substansmängden genom C=n/V I E-kolven sätter man en känd volym av det okända ämnet (titer). Här tillsätter man också en liten mängd indikator om detta behövs.
- 11. pH-skalan • Uppfanns i Danmark på Carlsberg bryggeri för att hålla reda på de mycket små mängder vätejoner som var avgörande för om det skulle bli ett gott öl eller en odrickbar sörja. • Beräknas enligt formeln: pH = -log[H+] • Är enligt ovan en 10 logaritmisk skala, vilket innebär att ett steg nedåt i pH skalan motsvarar 10 ggr surare lösning osv. • Vätejonkoncentrationen i en lösning med känt pH beräknas enligt: [H+] = 10-pH Ex. I en lösning med pH = 4,0 är vätejonkoncentrationen [H+] = 4,0 • Rent vatten har pH = 7,00 eftersom vätejonkoncentrationen i rent vatten efter auto- protolys är 10-7,00 mol/dm3 ==> pH= -log[10-7,00 ] = 7,00 • pH anges ofta i intervallet 0-14 men kan vara både lägre än noll och högre än 14 ex. I Koncentrerad saltsyra [HCl]=12 mol/dm3 blir pH = -log[H+] = -log 12 = -1,08 Koncentration anges ibland i kemin med hakparanteser kring den partikel vars koncentration anges, här H+
