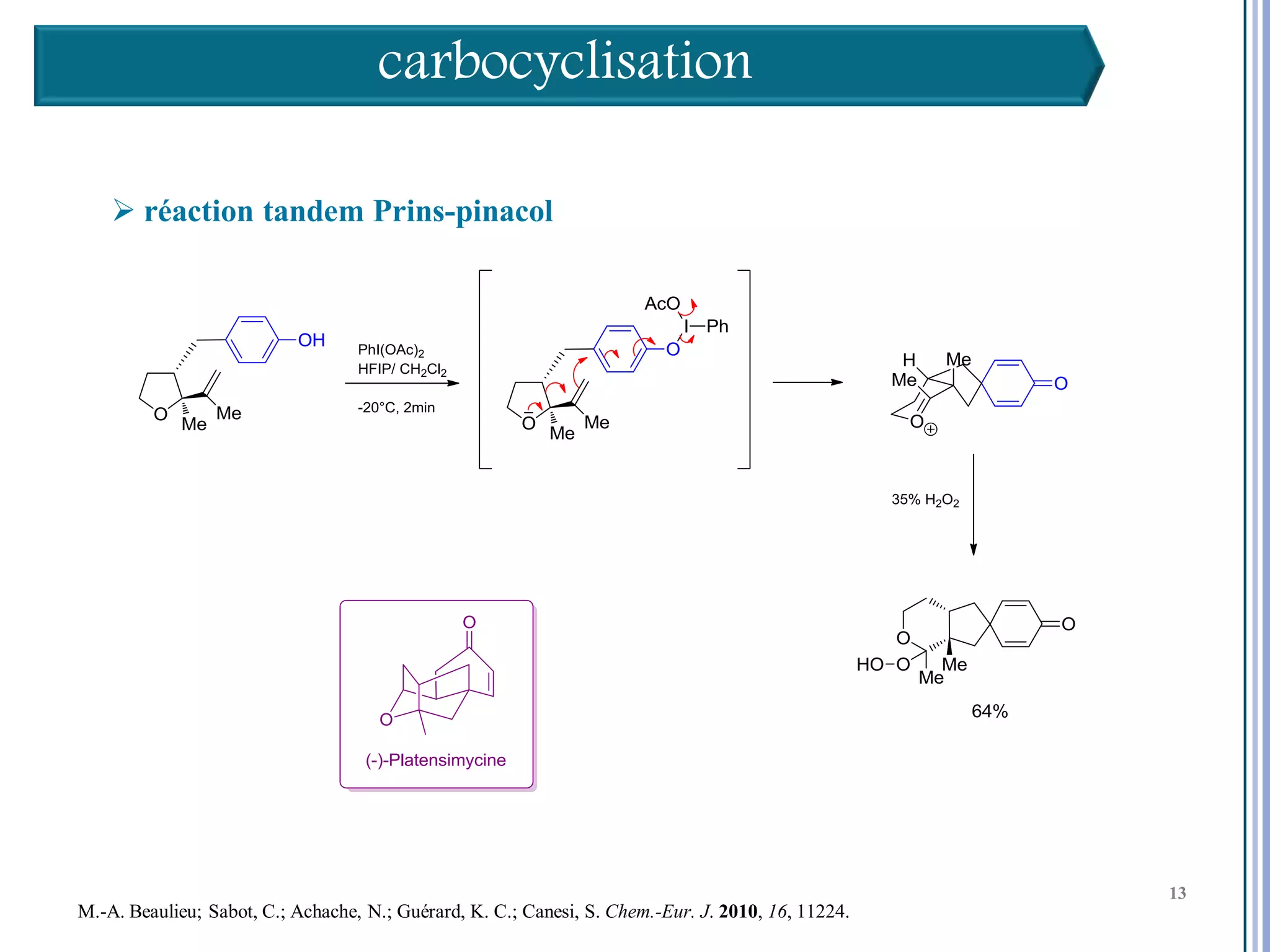
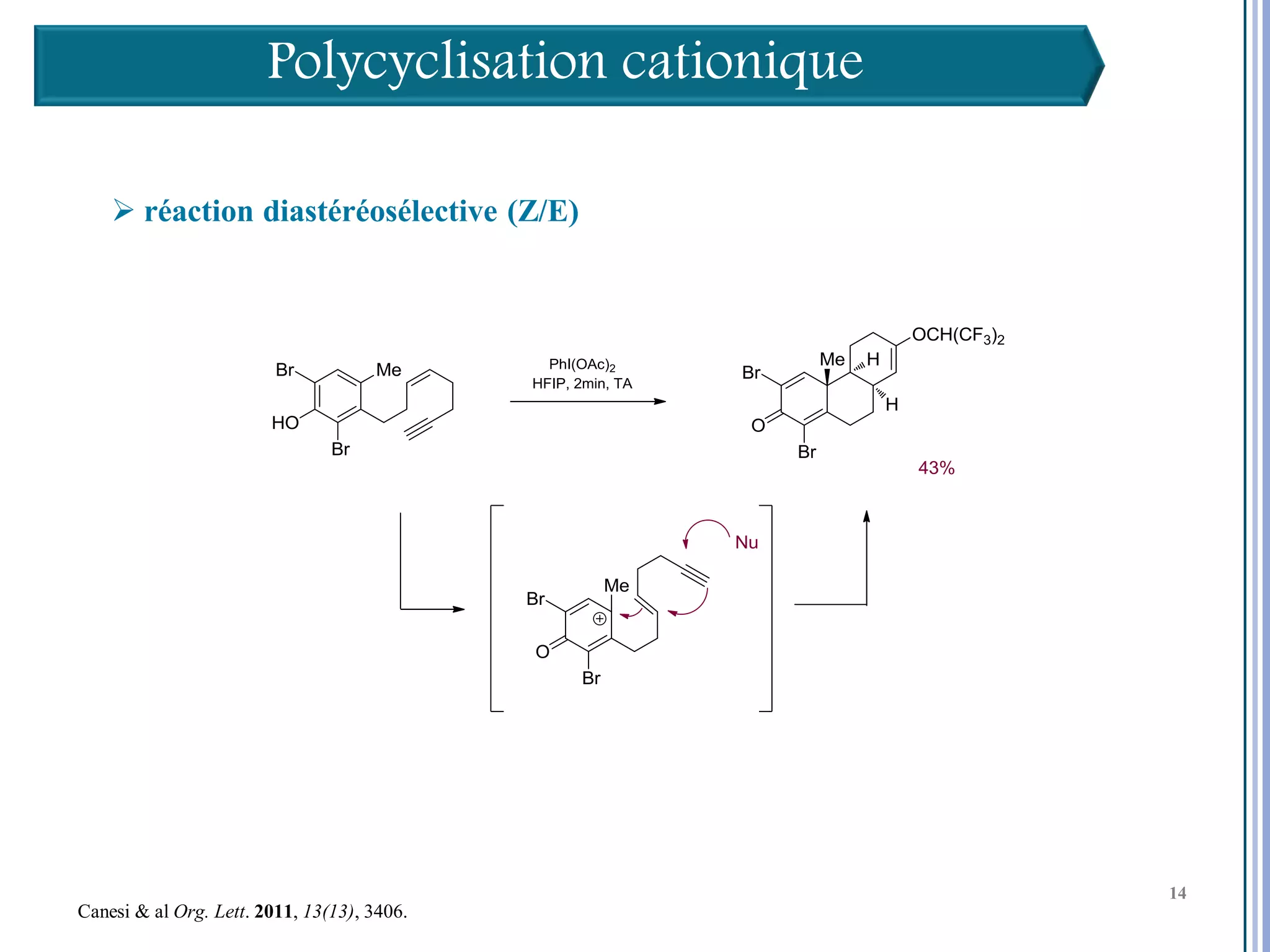
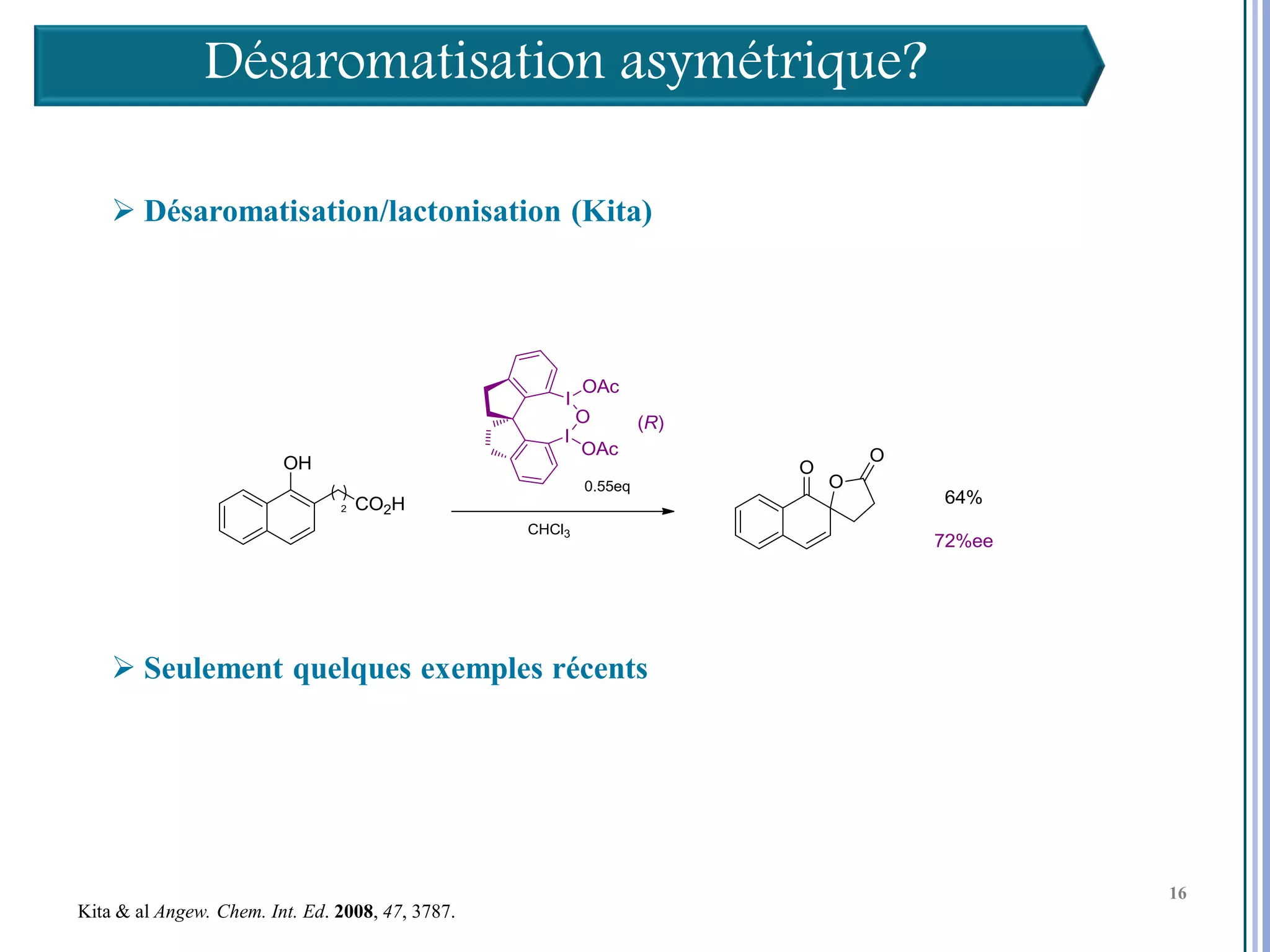
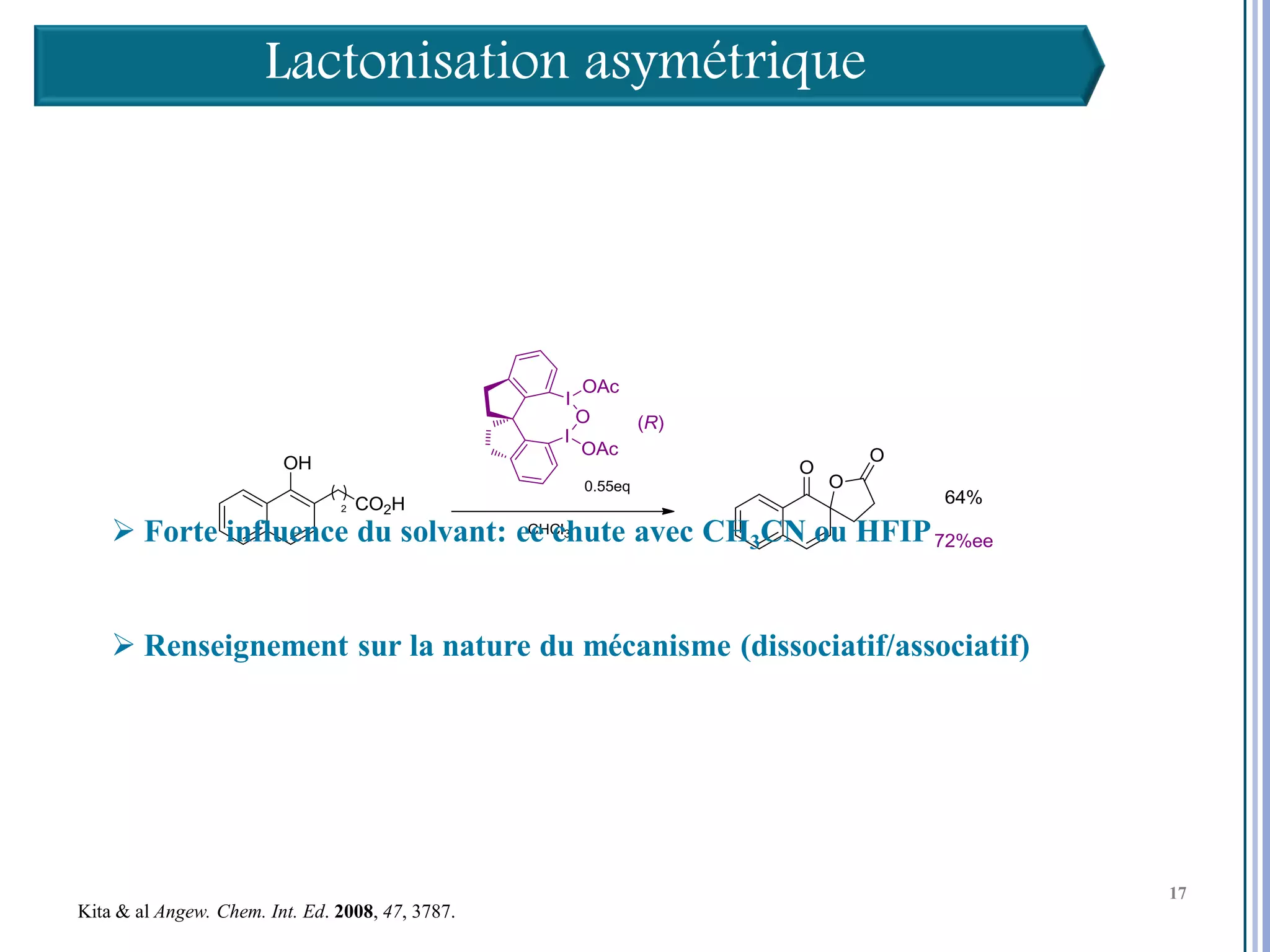
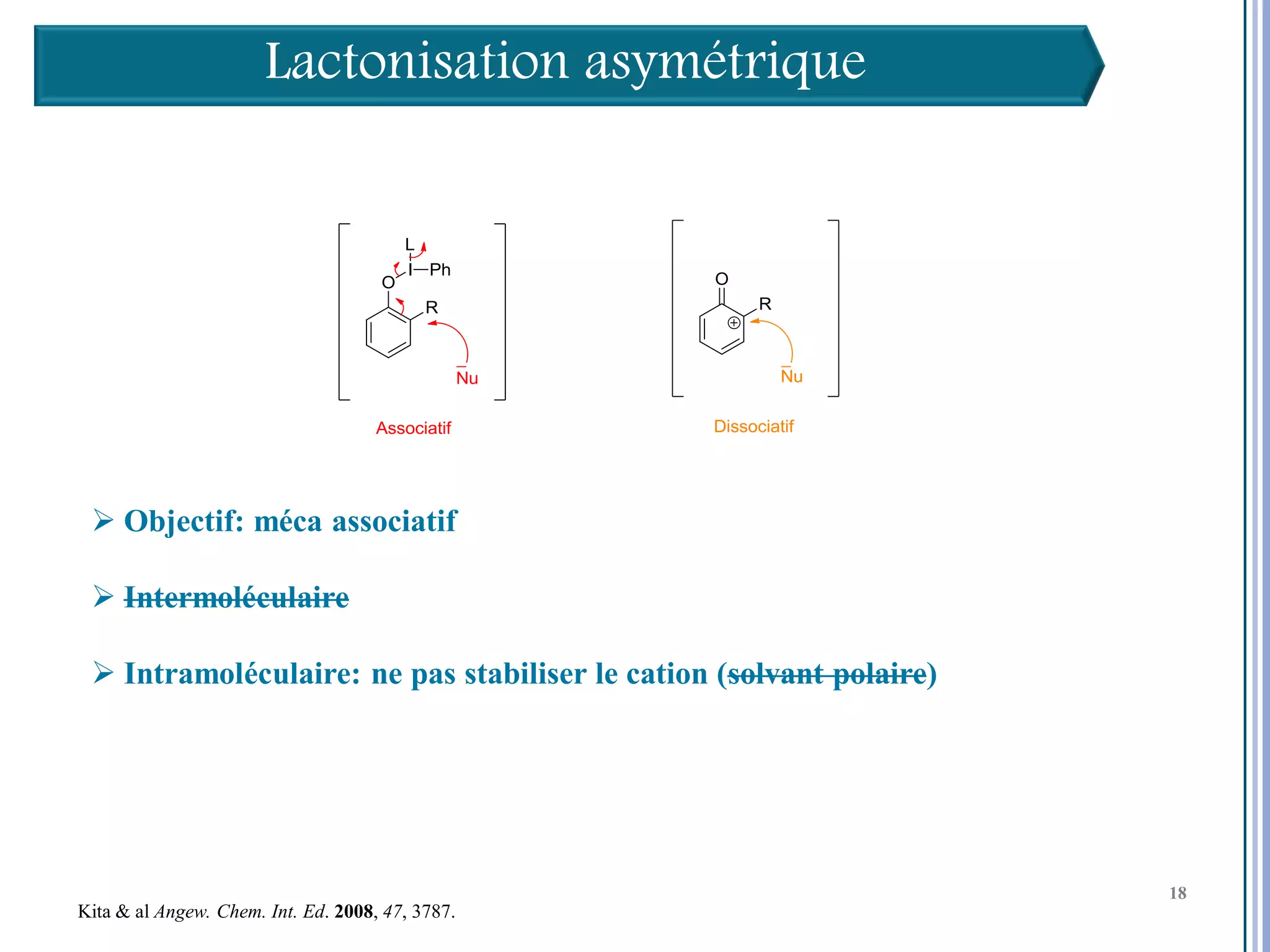
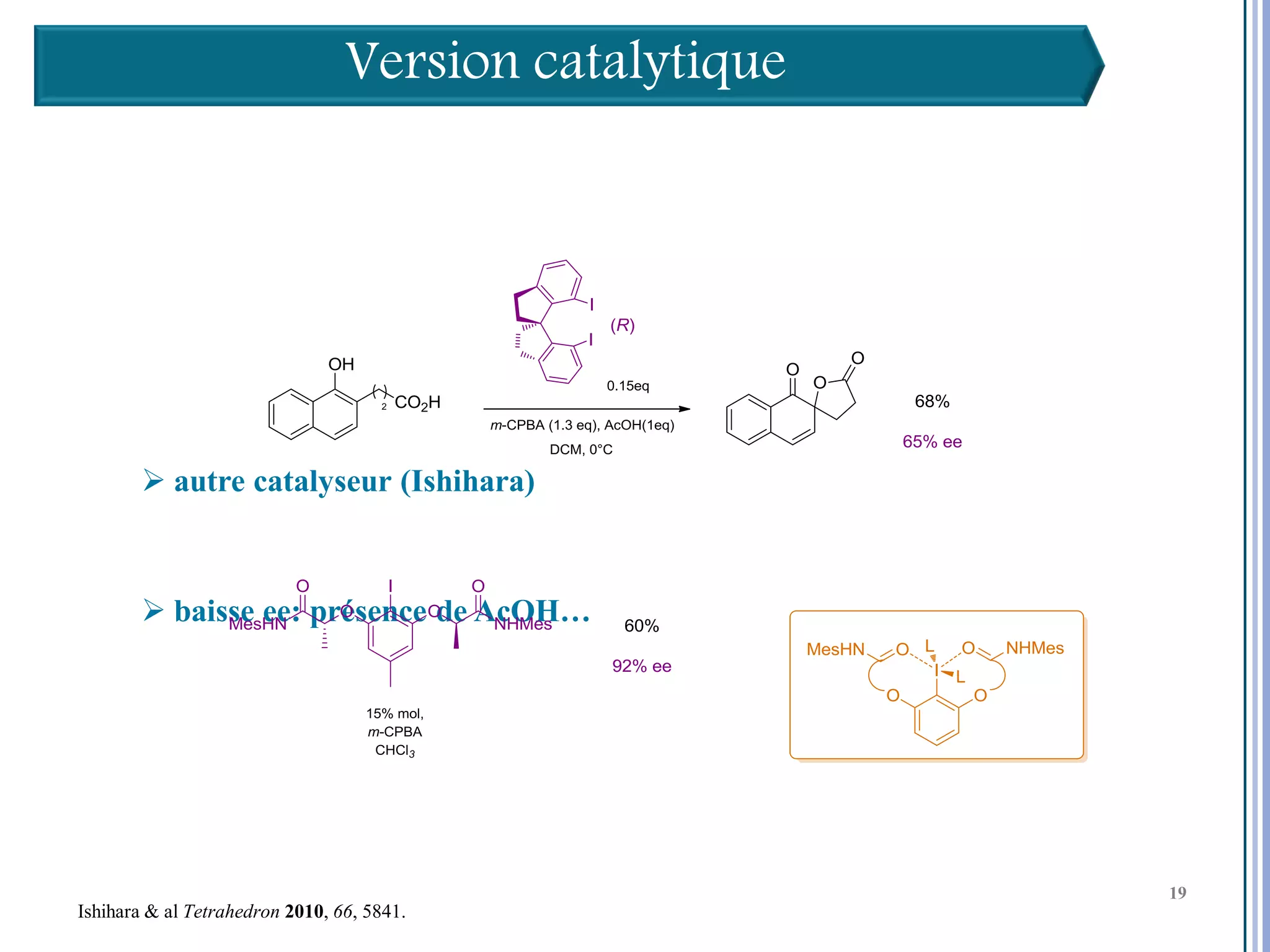
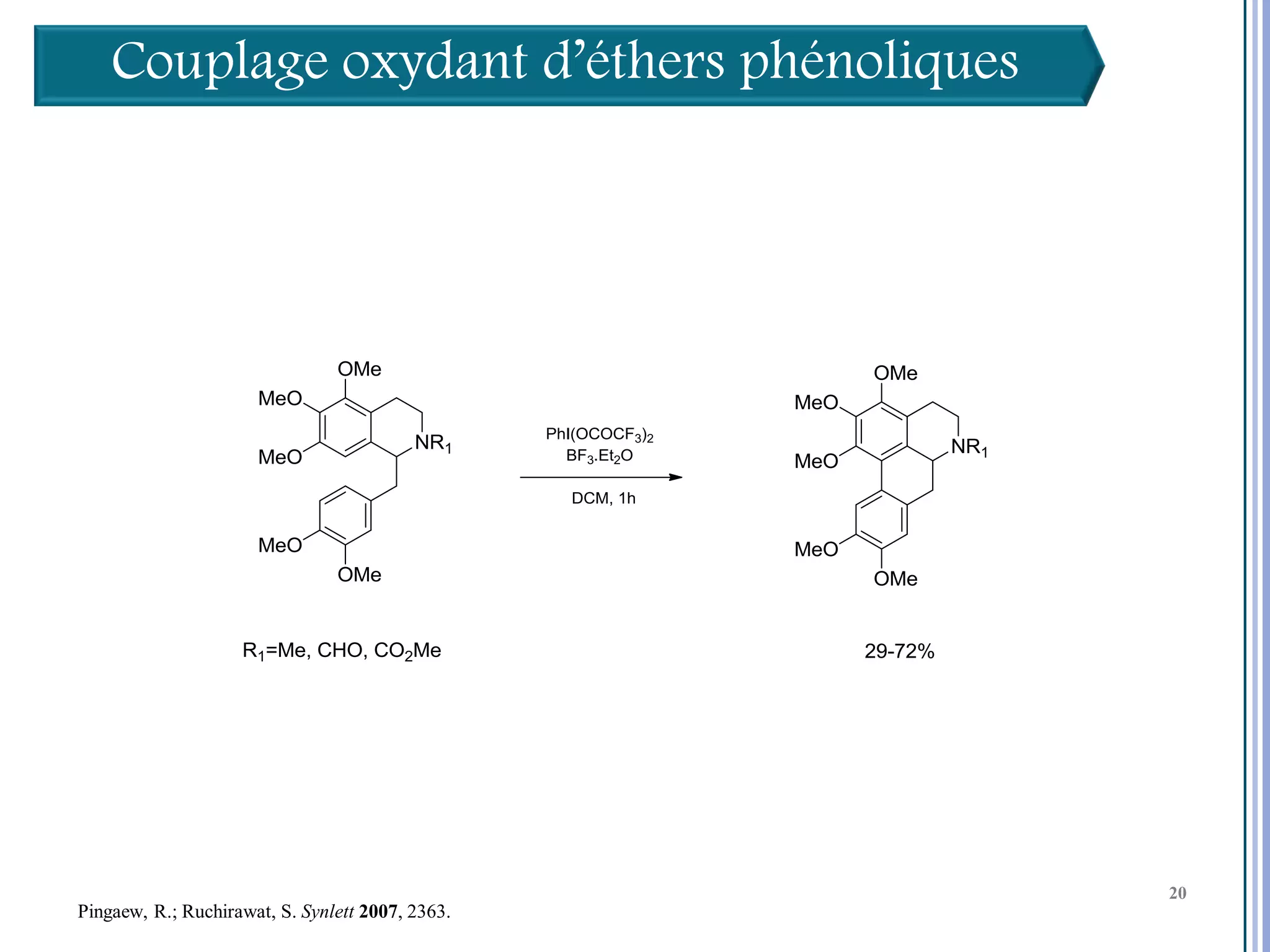
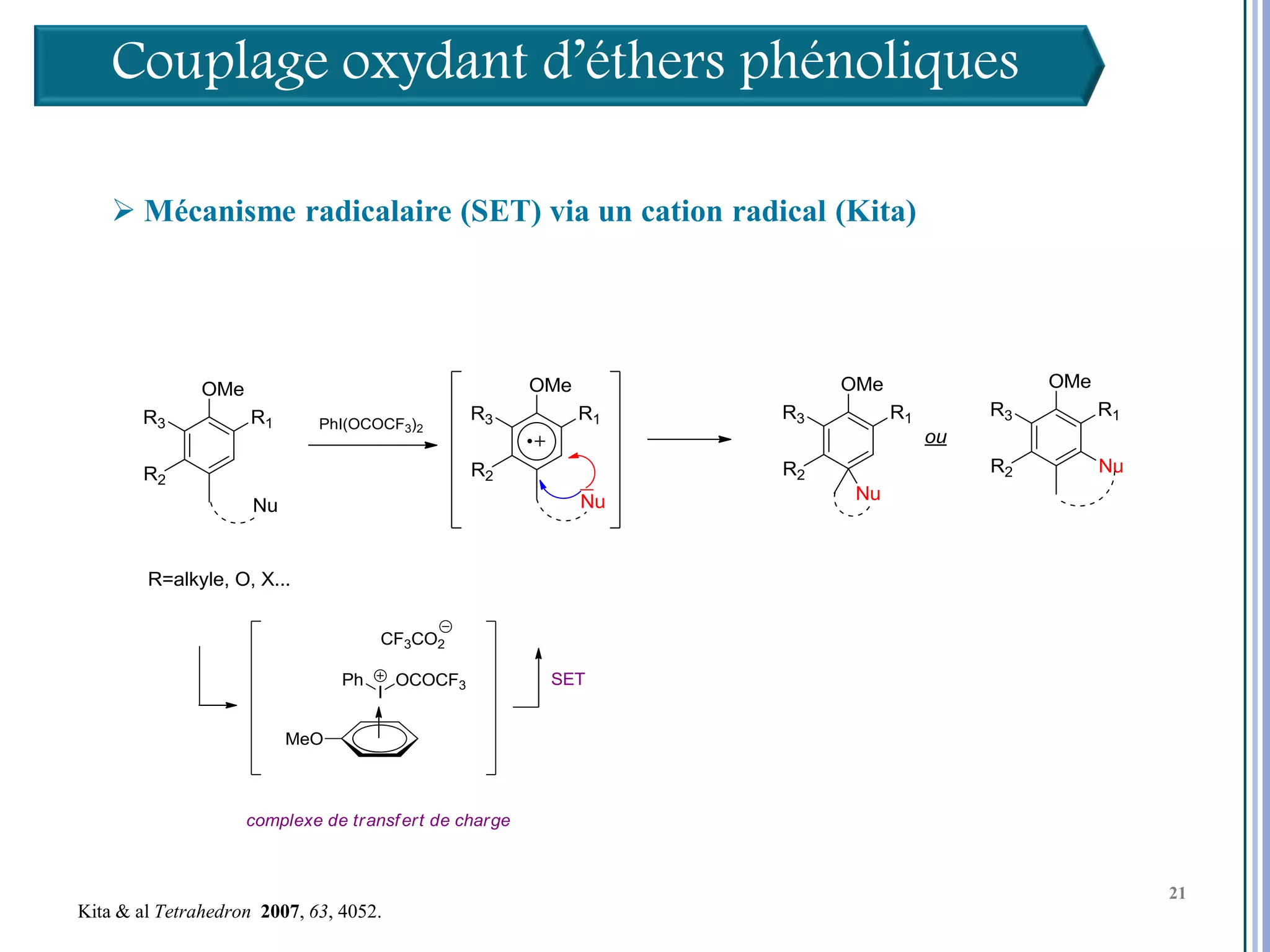
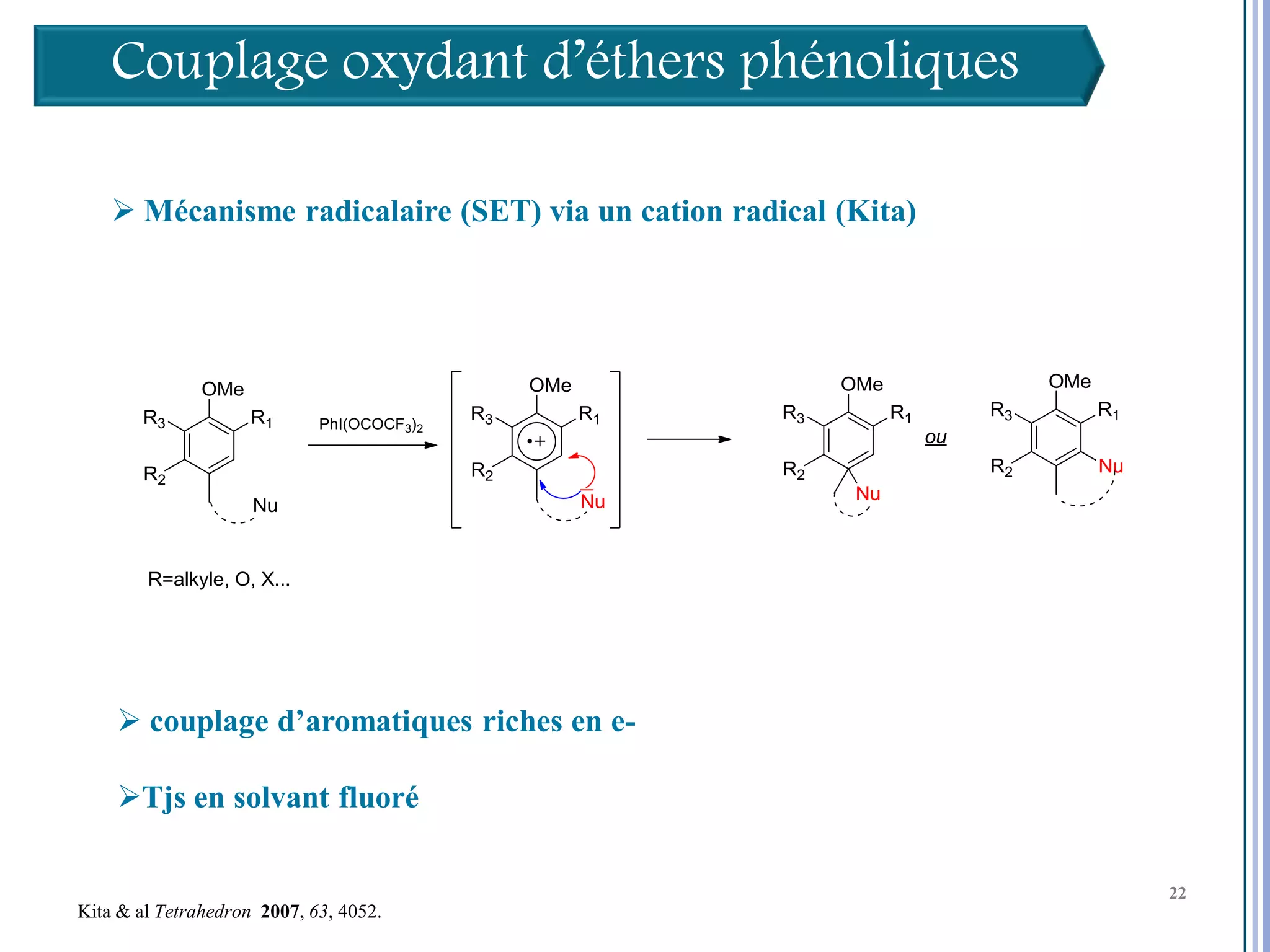
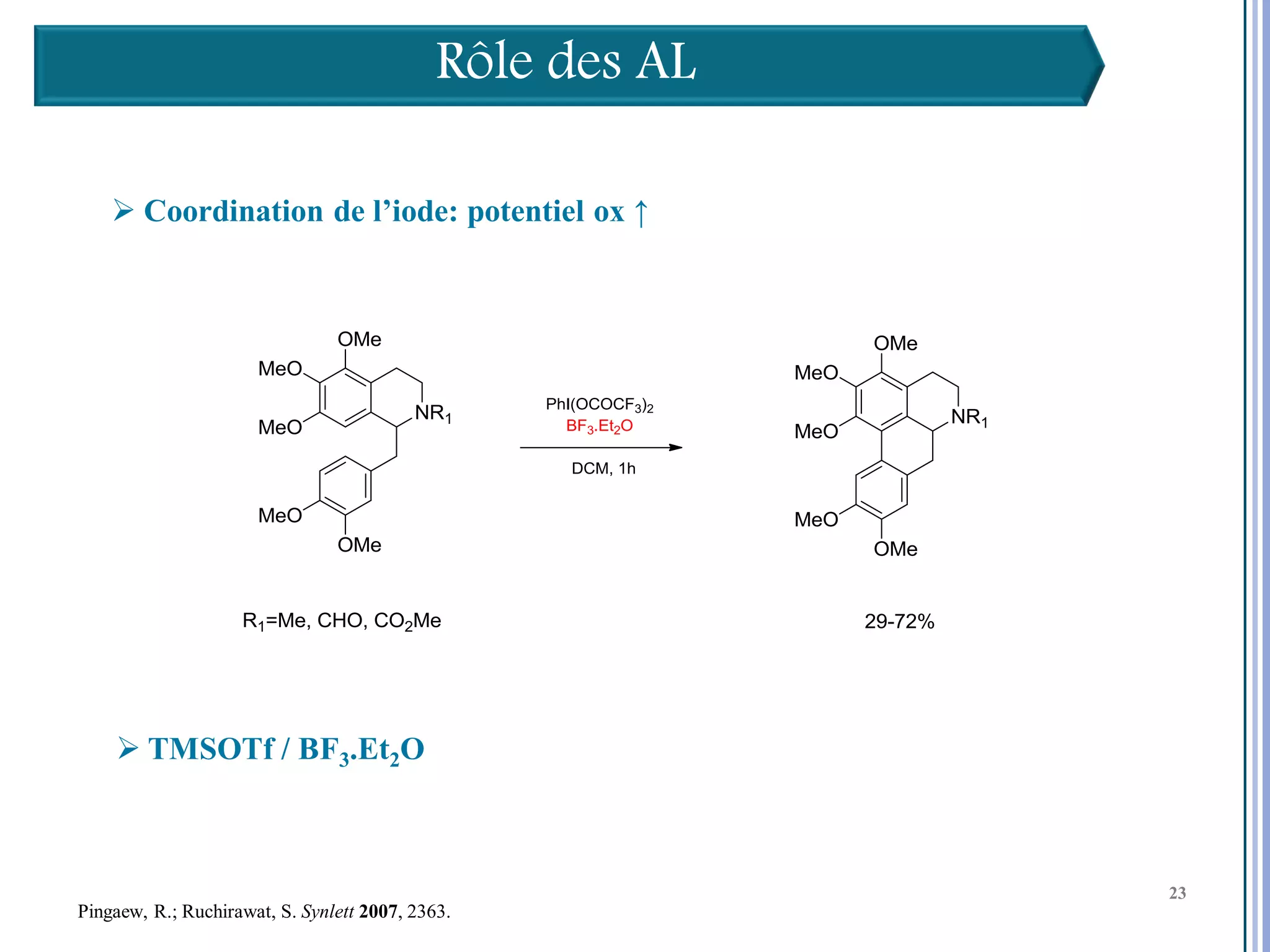
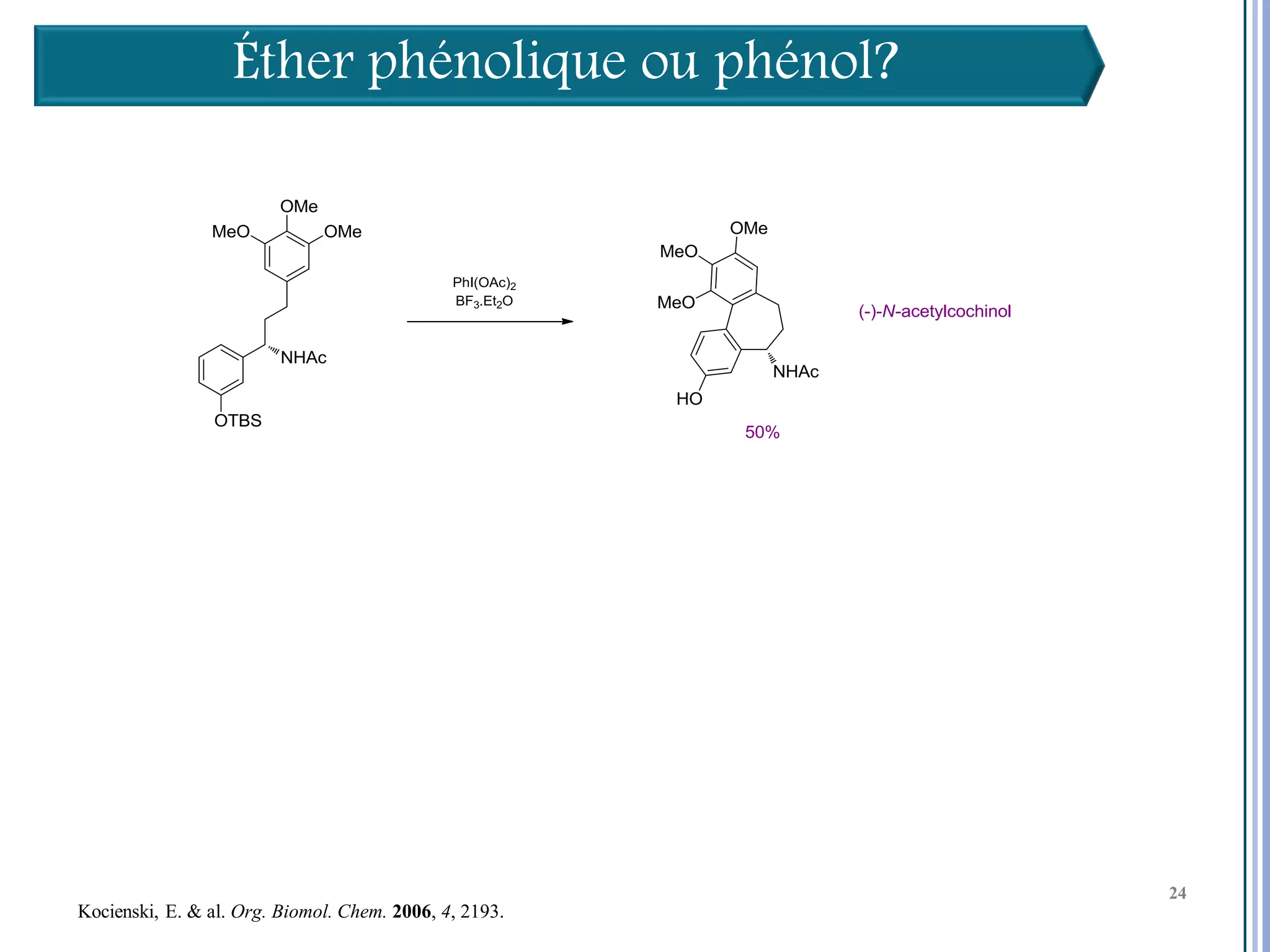
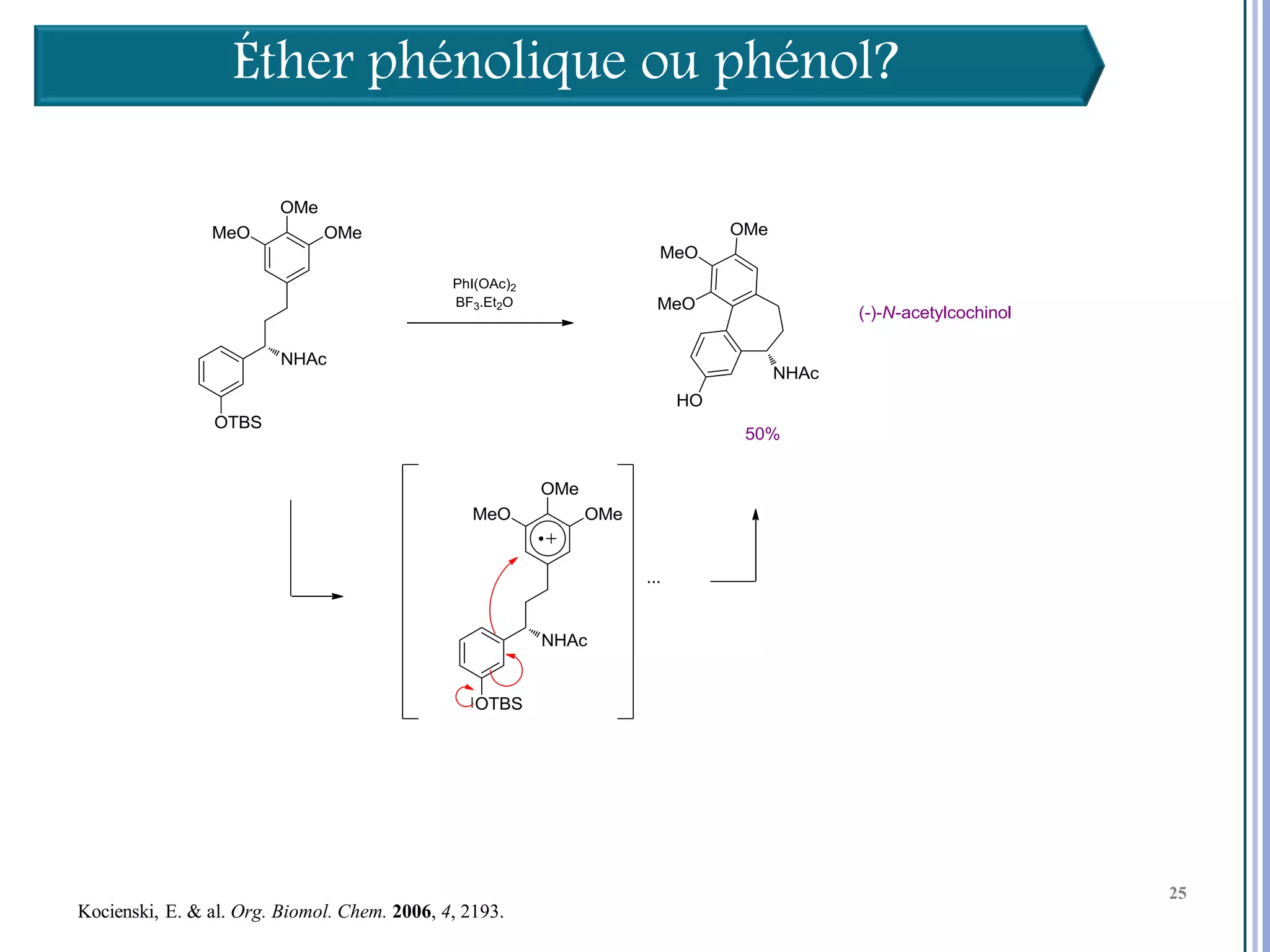
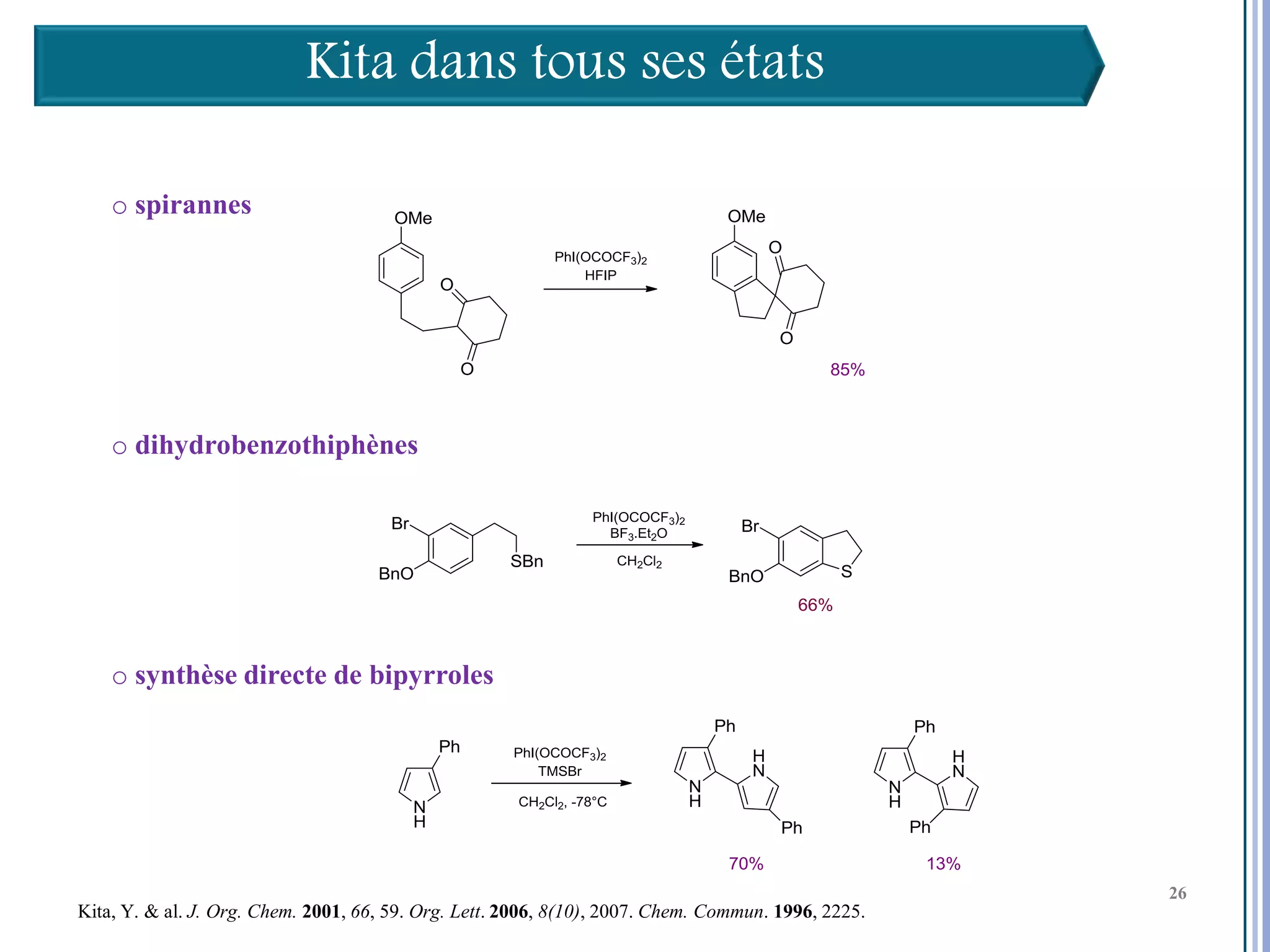
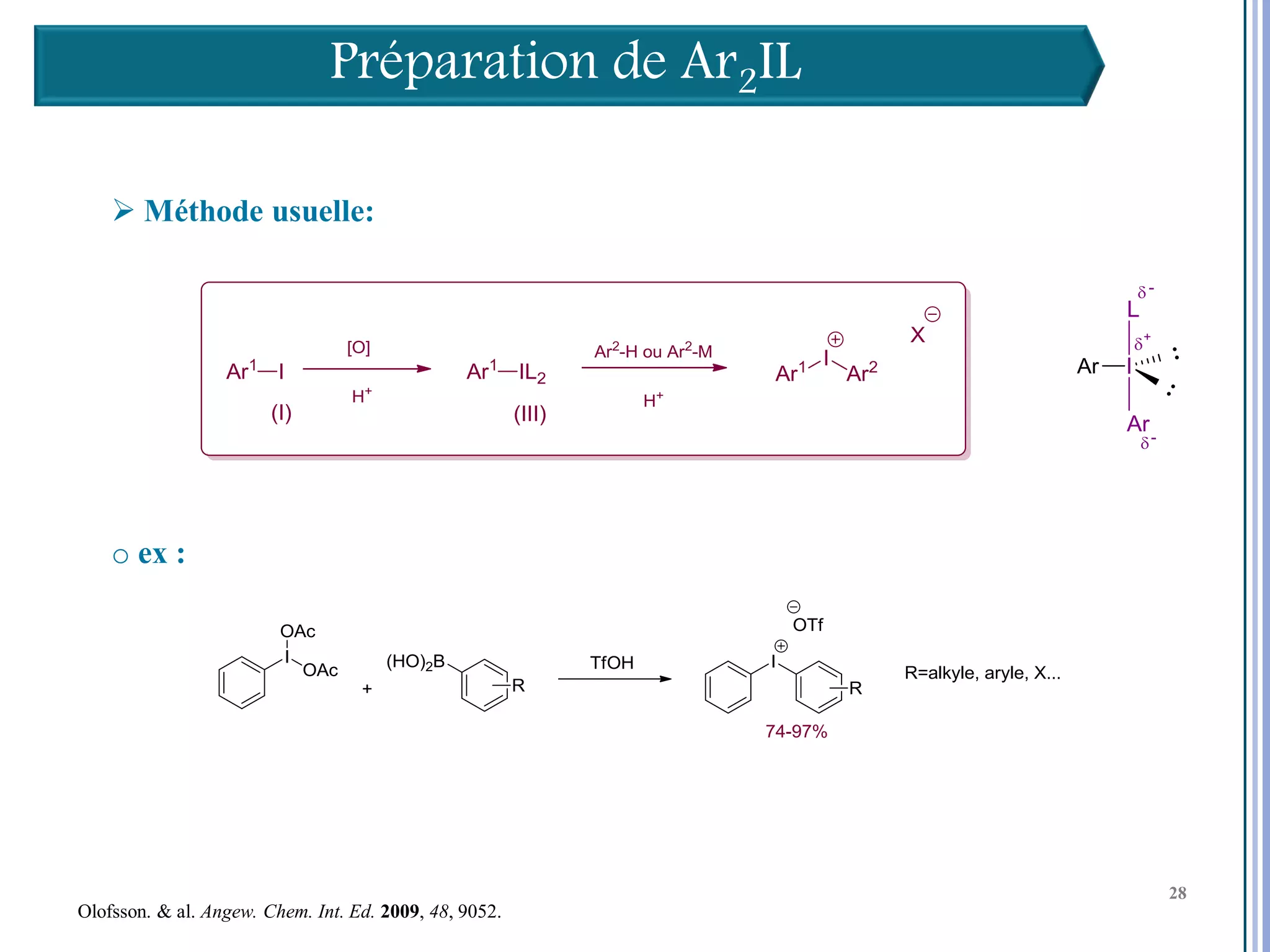
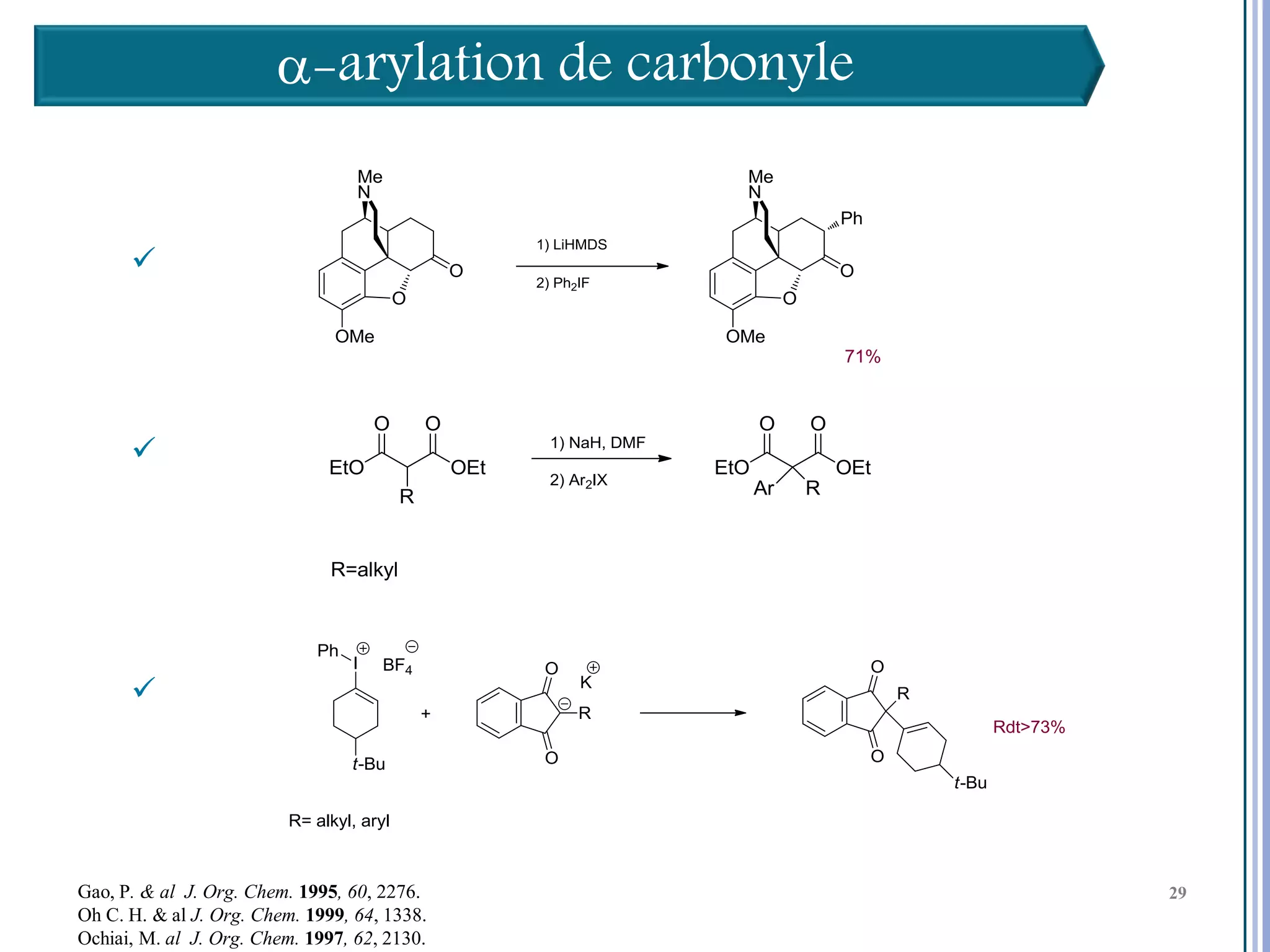
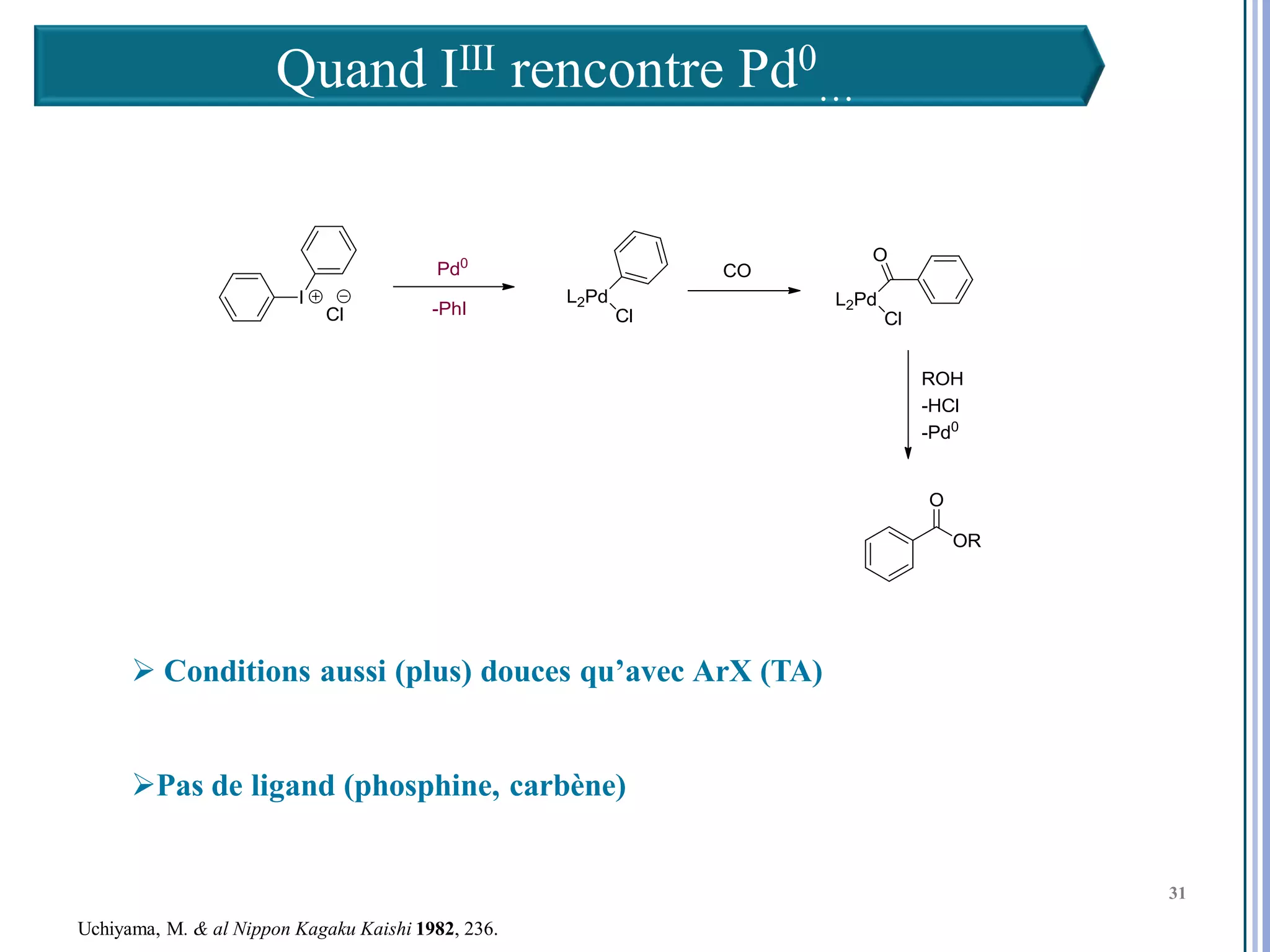
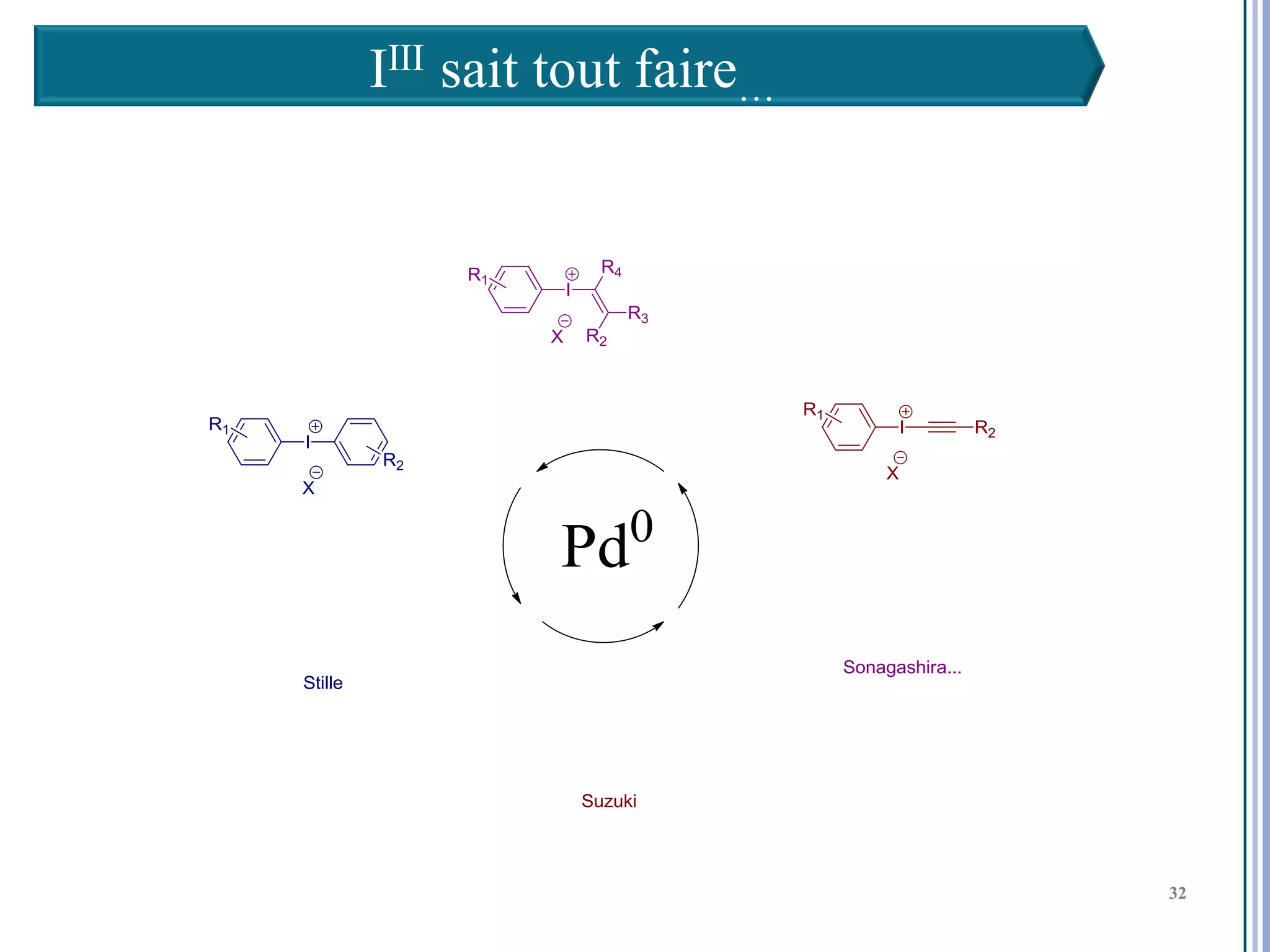
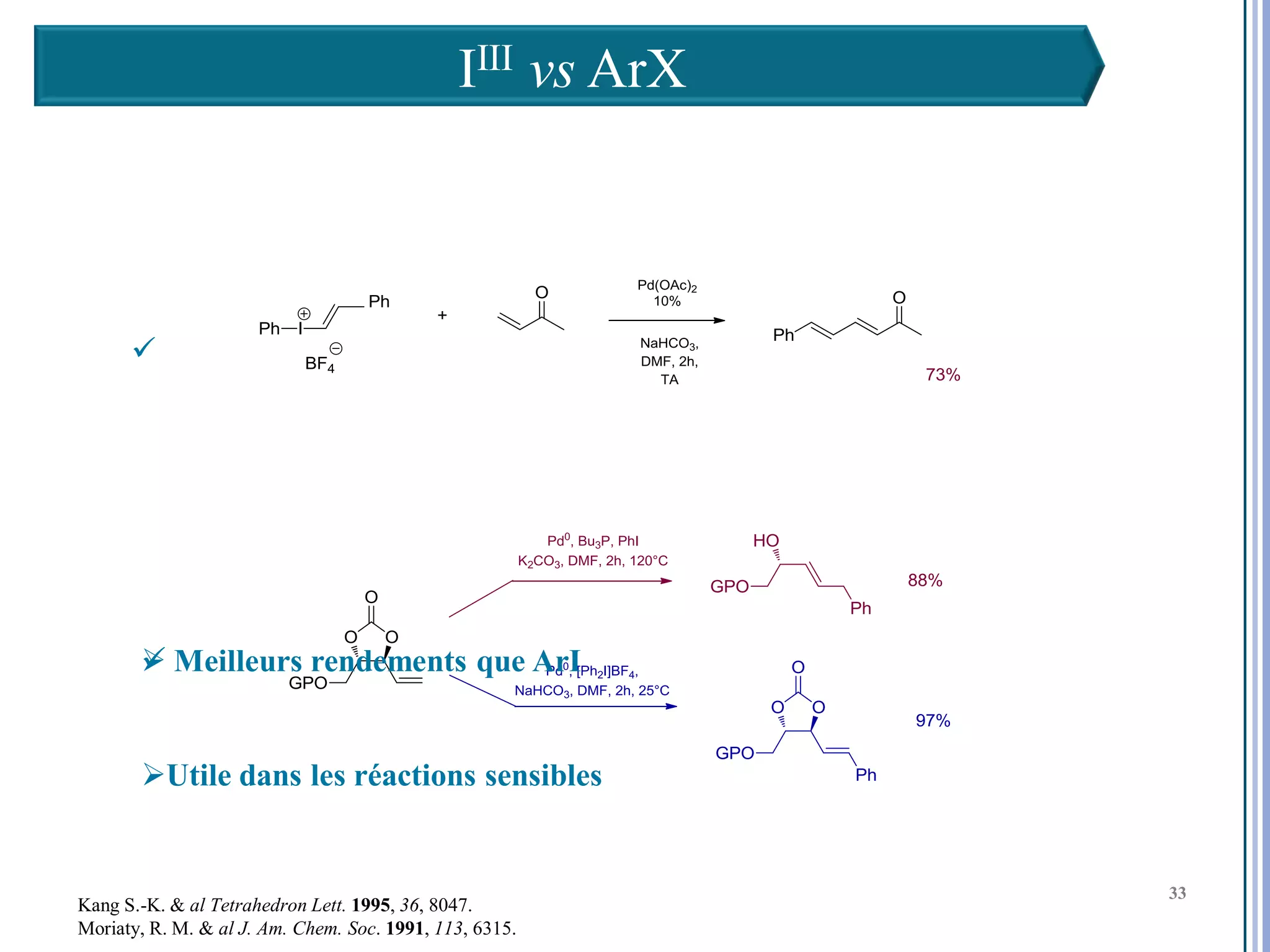
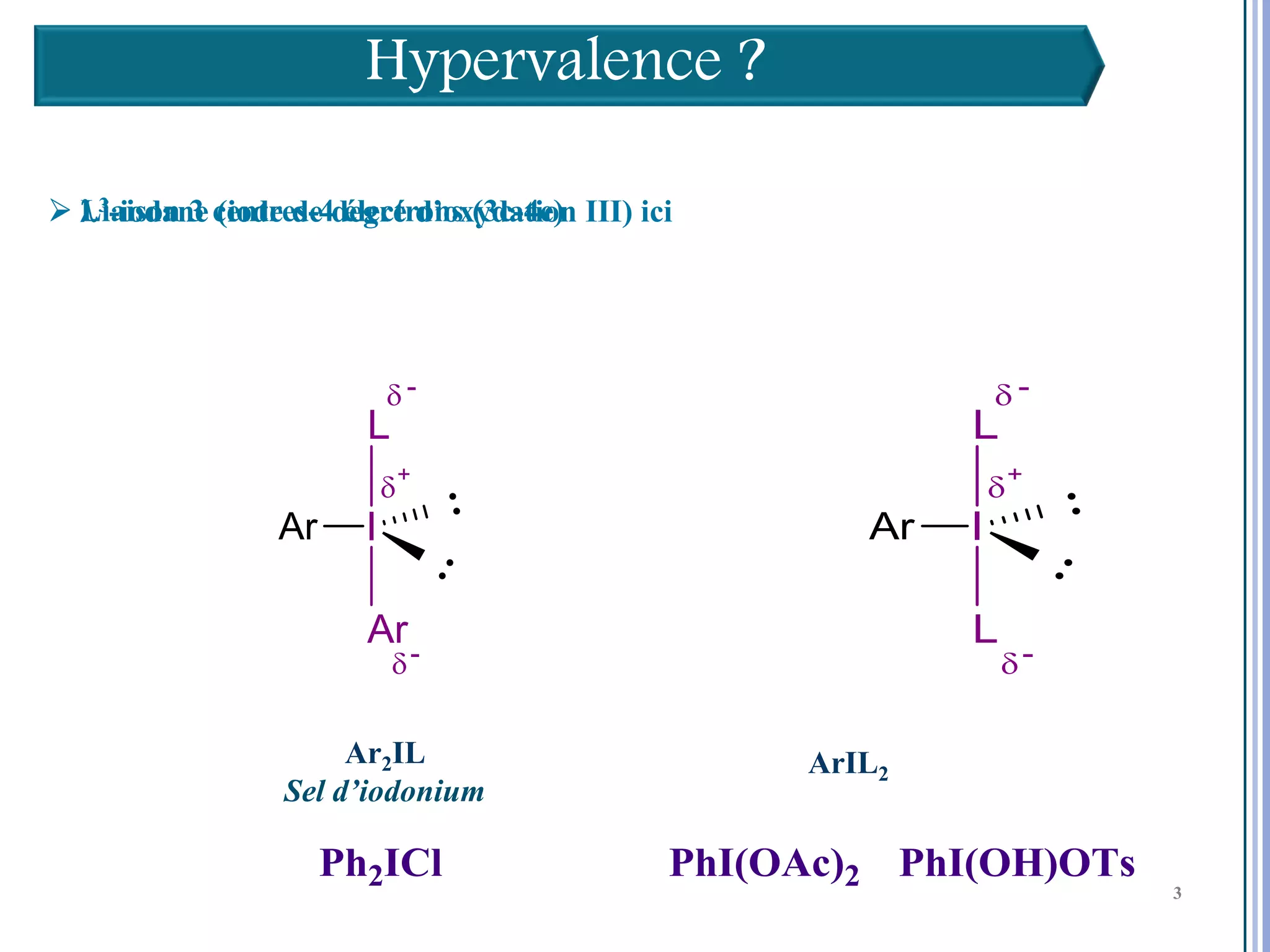
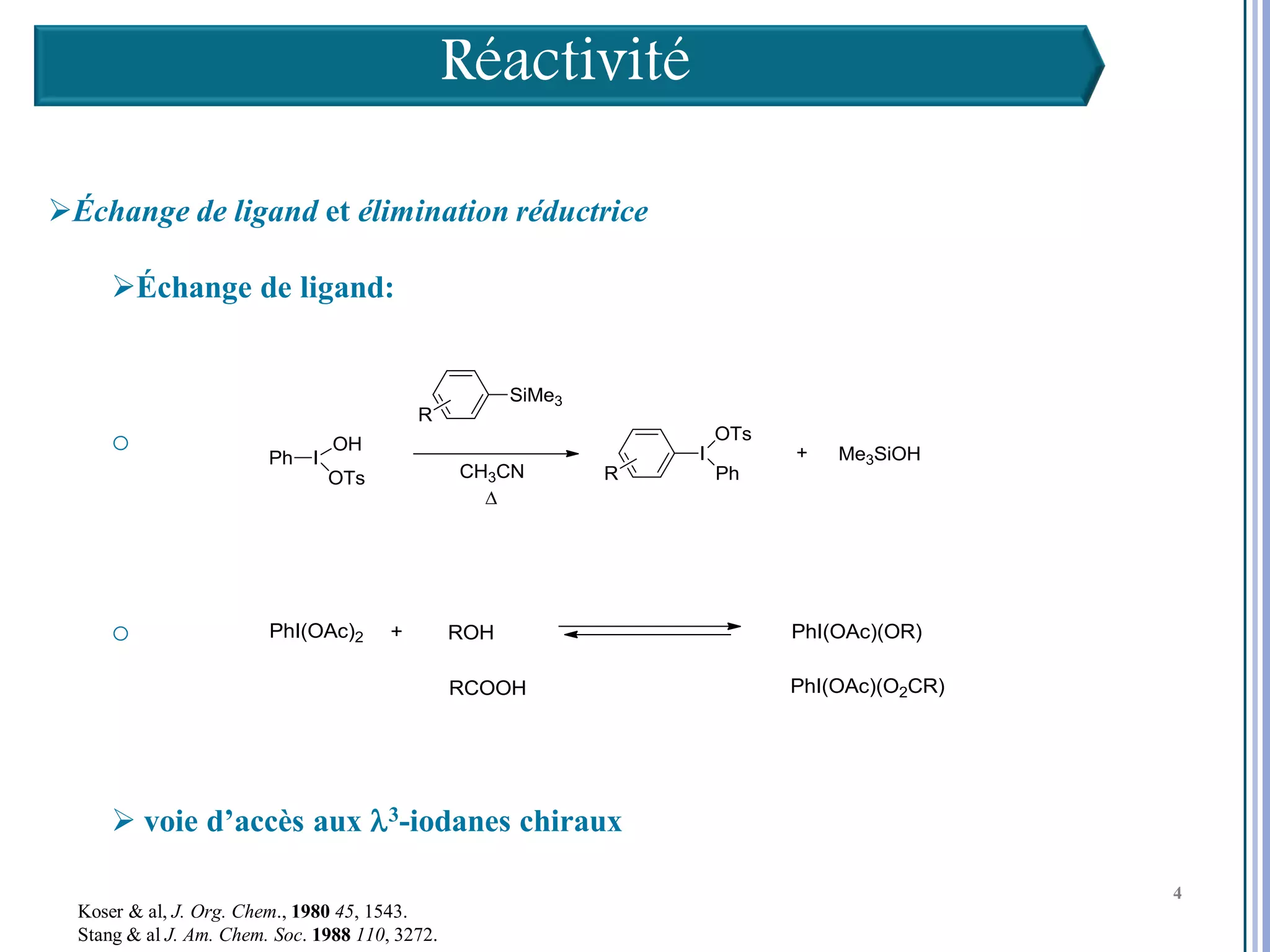
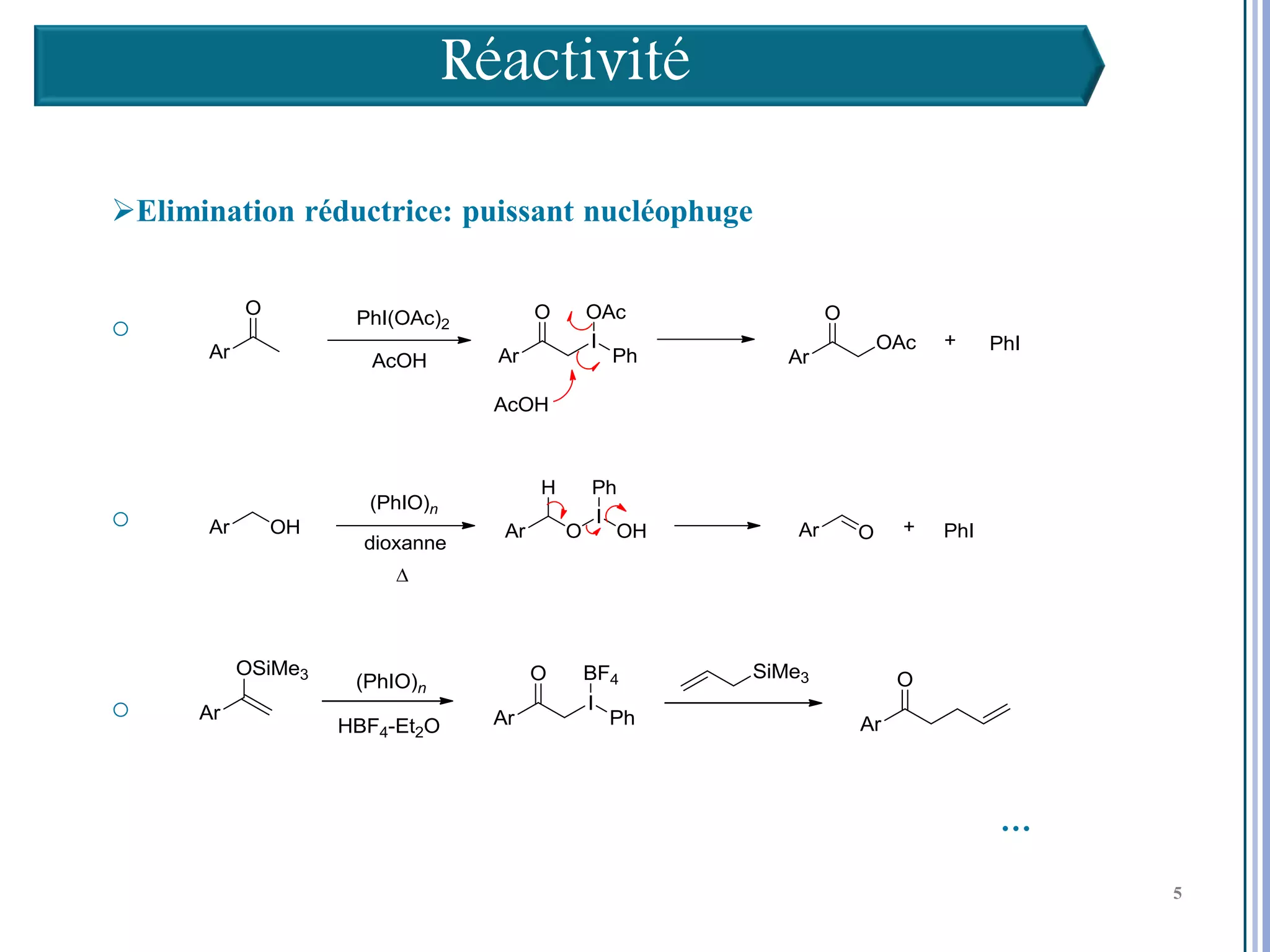
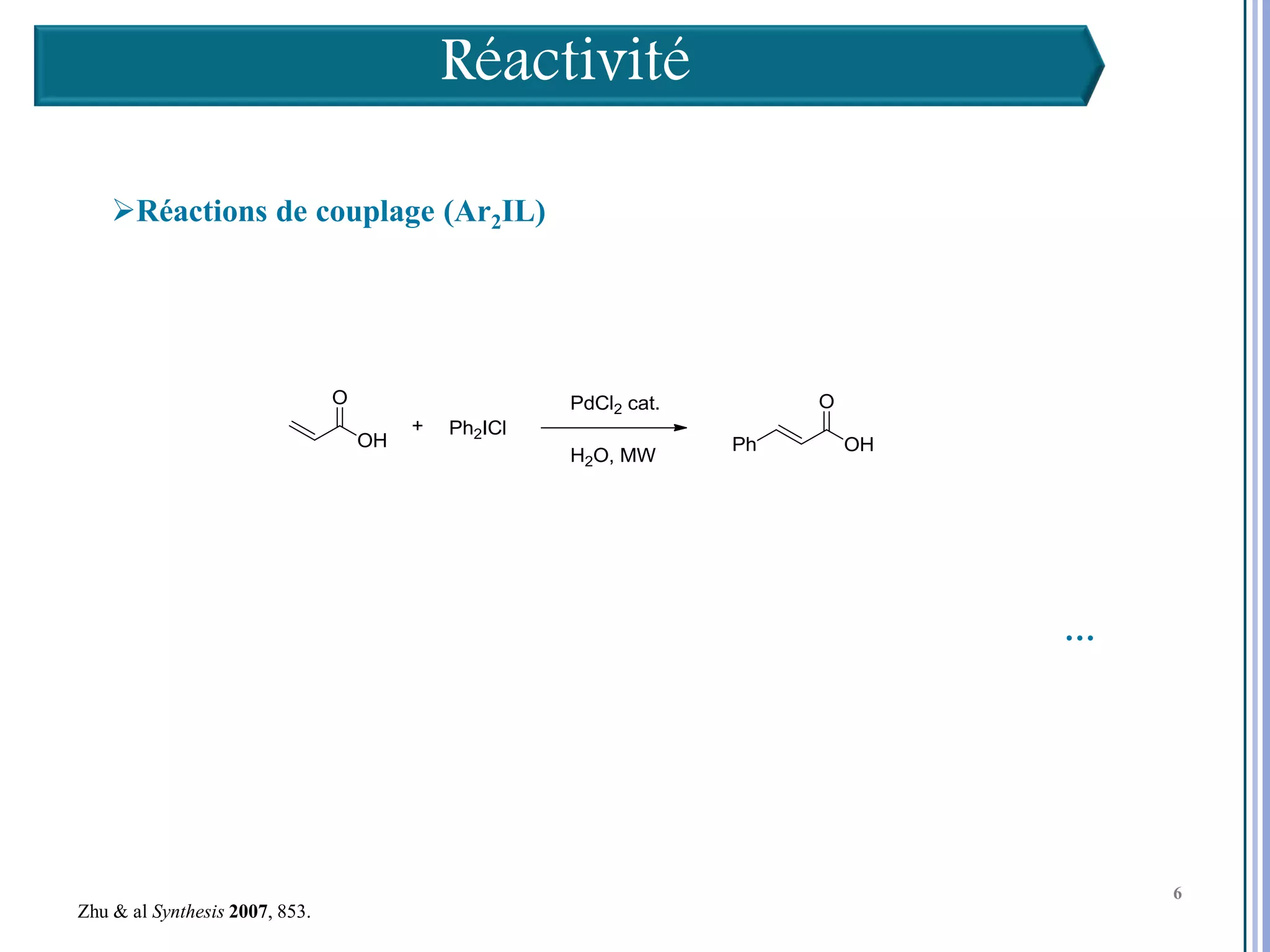
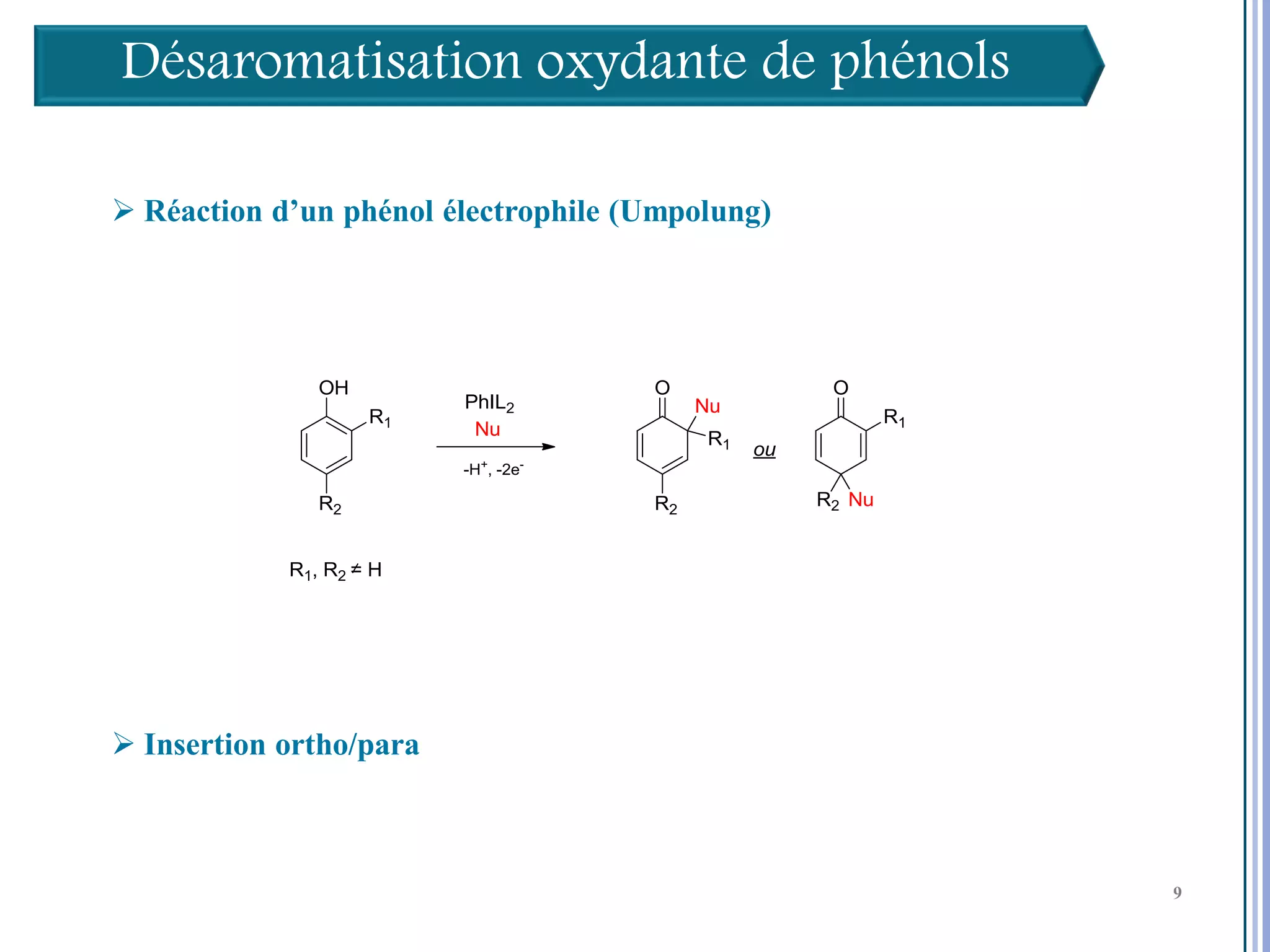
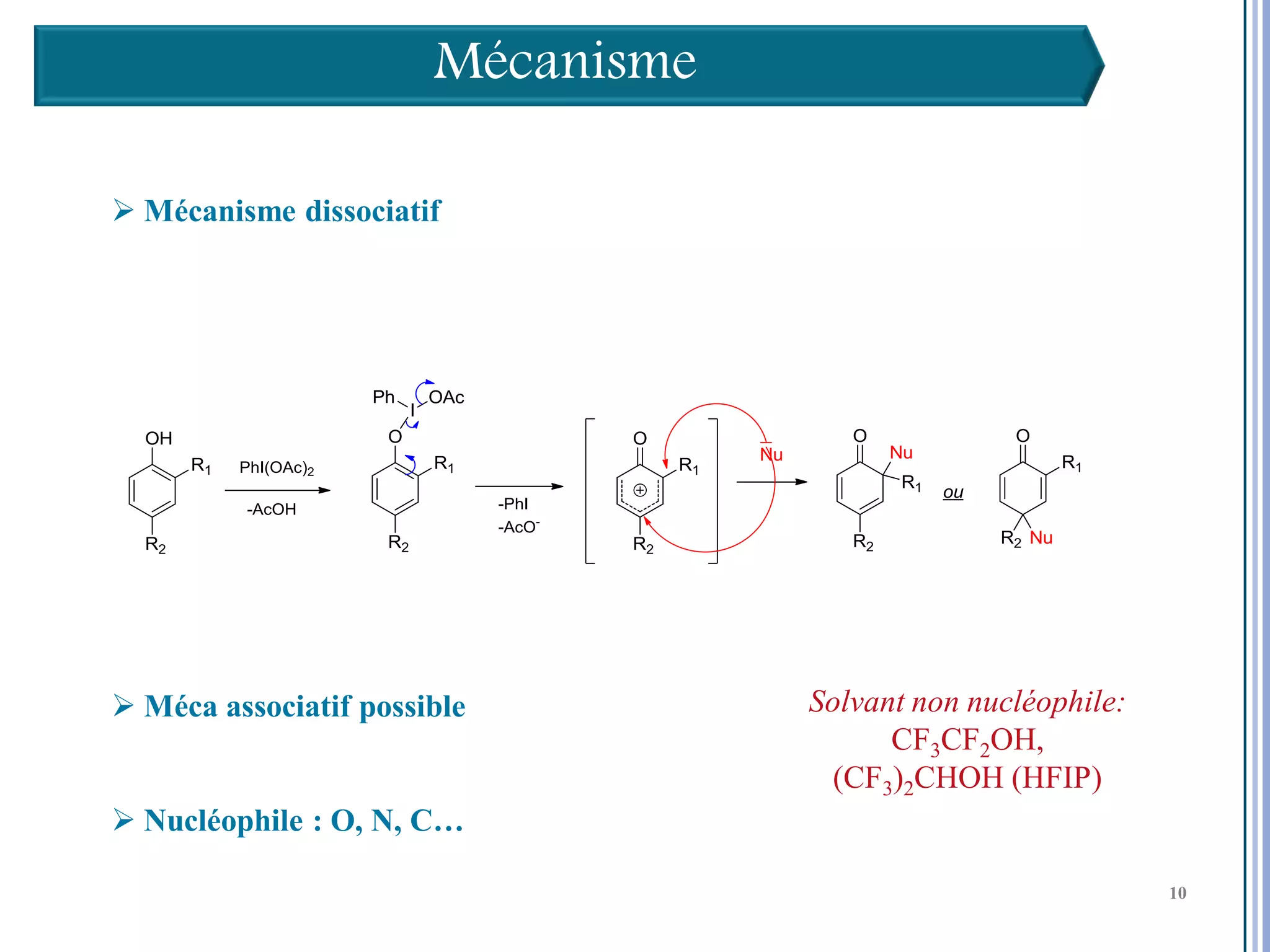
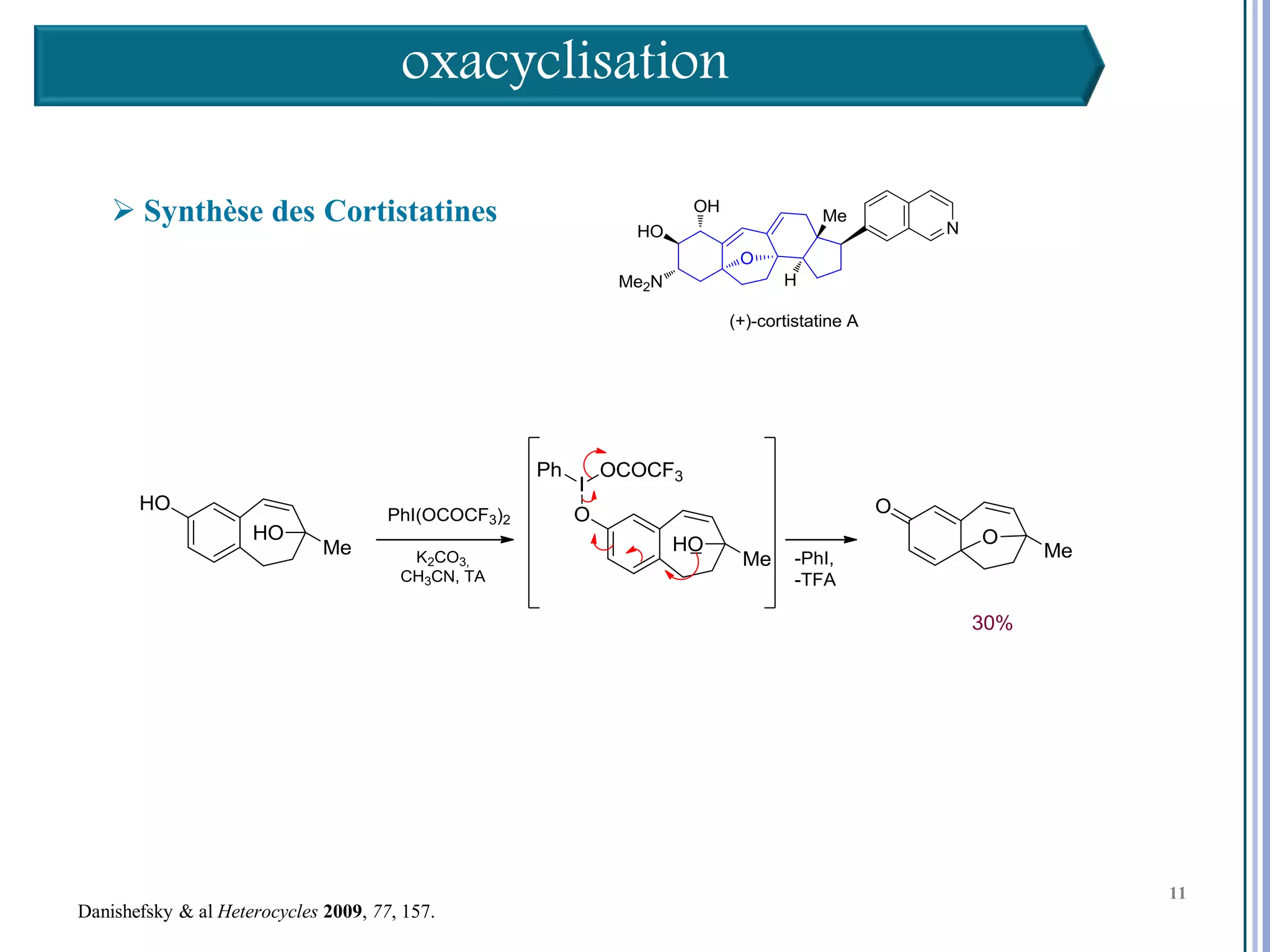
Le séminaire aborde l'iode hypervalent et ses applications en chimie, en mettant l'accent sur les réactivités, notamment l'échange de ligands et les réactions de couplage. Il souligne aussi l'importance des dérivés d'iode hypervalent comme des alternatives écologiques avec une faible toxicité. La discussion inclut des mécanismes variés et des exemples de synthèses impliquant des oxacyclisations et des désaromatisations.




![oxacyclisation
Synthèse de Sorensen
Oxydation/[3+2] tandem
12
12
12
Sorensen, E. J. Org. Lett. 2009, 11, 5394.](https://image.slidesharecdn.com/iodehypervalent-121010074950-phpapp01/75/Iode-hypervalent-12-2048.jpg)