Le document présente les concepts fondamentaux de la biologie cellulaire, en se concentrant sur la structure et les fonctions des cellules eucaryotes et de leurs biomembranes. Il décrit les différents organites, leurs caractéristiques et les mécanismes membranaires, ainsi que les aspects biochimiques associés. Enfin, il souligne l'importance de la biologie cellulaire dans la compréhension des maladies modernes.











































































![76 ANNÉE UNIVERSITAIRE 2016-2017 / THEME II - LA CELLULE : STRUCTURE ET FONCTIONS - PCEM1
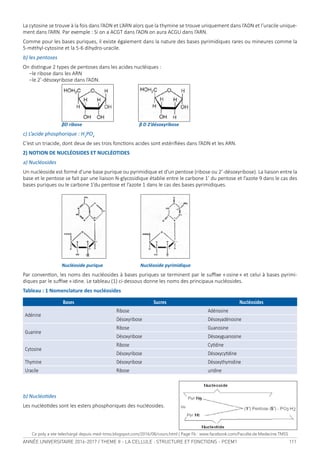
Le glycérol peut être estériié :
• Par un AG pour donner un monoacylglycérol (en 1 ou α) ou monoglycéride.(MAG)
• Par deux AG pour donner un diacylglycérol ou diglycéride. (DAG)
• Par trois AG pour donner un triacylglycérol ou triglycéride. (TAG)
Selon la nature des AG on disingue :
• glycérides homogènes ou simples (ne coniennent qu’un seul type d’AG).
• glycérides hétérogènes ou mixtes (coniennent 2 ou 3 AG diférents)
B- HYDROLYSE ENZYMATIQUE DES GLYCÉRIDES
3 lipases diférentes agissent sur les triglycérides :
• La lipase pancréaique hydrolyse les TG alimentaires dans la lumière intesinale. Cet enzyme exerce son acion grâce aux
sels biliaires et aux phospholipides de la bile (molécules à double polarité) qui émulsionnent les TG et les dispersent sous
forme de micelles.
• La lipoprotéine lipase plasmaique hydrolyse les TG circulants d’origine intesinale, transportée par les lipoprotéines, en
AG et glycérol.
• La TG lipase cellulaire (hormono sensible : acivée par le glucagon et les catécholamines et inhibée par l’insuline) hydrolyse :
− les TG qui sont apportés au foie par les lipoprotéines résiduelles (ou remnants) du catabolisme adipeux et musculaire.
− les TG qui sont stockés dans le issu adipeux, les muscles et le myocarde.
C- PROPRIÉTÉS PHYSIQUES DES GLYCÉRIDES
Point de fusion : Le point de fusion des glycérides dépend de la nature des AG qui le consituent.
Solubilité : Les glycérides sont insolubles dans l’eau et l’alcool à froid et solubles dans les solvants organiques et l’alcool à
chaud. Dans le sang les TG sont transportés sous forme de lipoprotéines (thème 6).
D- PROPRIÉTÉS BIOLOGIQUES DES GLYCÉRIDES
4 propriétés principales sont atribuées aux glycérides :
• Rôle de stockage : Les triglycérides (TG), pariculièrement abondants dans les cellules adipeuses (+ de 90 % des lipides)
consituent une réserve énergéique. Chez les obèses plusieurs kg de TG sont déposés dans les cellules adipeuses en
quanité suisante pour assurer les besoins énergéiques de base pendant plusieurs mois. À l’inverse le corps ne peut
stocker de l’énergie sous forme de glycogène que pour ses besoins pendant moins d’un jour. Ainsi les TG sont bien mieux
adaptés que le glycogène à servir de stockage d’énergie.
• Rôle de souien : Les glycérides riches en AG saturés sont solides. Ils paricipent à la structure des organes. Exemple :
graisses de souien de l’utérus
• Rôle de lubriicaion : Les glycérides riches en AG insaturés sont liquides. Ils permetent de faire glisser les organes les uns
par rapport aux autres. Exemples : les graisses périrénales.
• Rôle d’isolant thermique : Les graisses sous-cutanées (panicule adipeux) servent d’isolant thermique contre la déperdi-
ion de chaleur.
III-LES GLYCEROPHOSPHOLIPIDES
Les glycérophospholipides (GPL) sont des dérivés de l’acide phosphaidique :
[glycérol + 2 AG : R1(α) = AG saturé, R2(β) : AG insaturé + phosphate (α »)]
Glycérophospholipide
Ce poly a ete telechargé depuis med-tmss.blogspot.com/2016/08/cours.html | Page Fb : www.facebook.com/Faculte.de.Medecine.TMSS](https://image.slidesharecdn.com/poly-pcem1-biochimiestructurale-bilogiecellulaire-161018085909/85/Poly-pcem1-biochimie-structurale-bilogie-cellulaire-76-320.jpg)














































![124 ANNÉE UNIVERSITAIRE 2016-2017 / THEME II - LA CELLULE : STRUCTURE ET FONCTIONS - PCEM1
IV-CINÉTIQUE ENZYMATIQUE
A-CINÉTIQUE MICHAELIENNE
1- Vitesse iniiale
Soit la réacion : S P catalysée par une enzyme (E).
La vitesse de réacion est la quanité de S disparue par unité de temps ou la quanité de P apparue par unité de temps. Elle
est proporionnelle à la concentraion de S.
V = k [S]
Si on mesure la quanité de P formée en foncion du temps pour des concentraions de [E] et de [S] données, on obient
la courbe suivante
Déterminaion de la vitesse iniiale d’une réacion enzymaique et de sa vitesse à l’instant t.
La courbe P= f(t) est :
- d’abord linéaire ascendante : l’enzyme est saturée par son substrat, la vitesse est constante ; c’est la période d’état sta-
ionnaire
- puis s’inléchit : l’enzyme n’est plus saturée par son substrat, la vitesse décroît.
- et enin, devient horizontale : l’équilibre de la réacion est ateint et la vitesse est nulle.
À l’instant t, V = tgte α.
À l’instant t0 : Vi = tgte α0
(vitesse iniiale).
2- Constante de Michaelis
L’ensemble du processus enzymaique peut être expliqué par la formaion du complexe ES qui donne le produit P :
k1 kcat
E + S [ES] E + P
k -1
k1 = constante d’associaion, k -1 = constante de dissociaion et kcat = constante catalyique.
On déinit la constante de Michaelis Km comme la constante de dissociaion de ES.
Km = k -1 + k cat / k 1
3- Courbe de Michaelis
Si on uilise une concentraion donnée en enzyme et des [S] croissantes, on obient la courbe de Michaelis Vi= f(S) (branche
d’hyperbole) qui répond à l’équaion :
Vi= Vmax. [S] / Km + [S]
Variaion de la vitesse iniiale en foncion de la concentraion en substrat, celle de l’enzyme étant constante.
Ce poly a ete telechargé depuis med-tmss.blogspot.com/2016/08/cours.html | Page Fb : www.facebook.com/Faculte.de.Medecine.TMSS](https://image.slidesharecdn.com/poly-pcem1-biochimiestructurale-bilogiecellulaire-161018085909/85/Poly-pcem1-biochimie-structurale-bilogie-cellulaire-124-320.jpg)
![ANNÉE UNIVERSITAIRE 2016-2017 / THEME II - LA CELLULE : STRUCTURE ET FONCTIONS - PCEM1 125
Ainsi on détermine expérimentalement les 2 constantes cinéiques Km et Vmax.
- Vmax : Lorsque la [S] est très élevée, la Vi sera égale à Vmax.
Ceci est réalisé lorsque tous les sites enzymaiques sont saturés en S.
- Km est égale à la concentraion du substrat lorsque Vi= Vmax / 2
Elle s’exprime comme le substrat en M.
On déinit l’unité enzymaique UE comme étant la quanité d’enzyme qui catalyse la transformaion d’une micromole de S
par min dans des condiions déterminées (température, pH, force ionique). Elle s’exprime en unité internaional (UI).
On appelle acivité spéciique AS le nombre d’UE par mg de protéine d’une préparaion enzymaique. C’est un critère de
pureté d’une enzyme. Si l’enzyme est pure, l’acivité spéciique n’augmente plus.
4- Courbe de Lineweaver-Burk
Si on représente 1/Vi en foncion de 1/S on obient la courbe de Lineweaver et BurK qui est une droite répondant à l’équa-
ion ci-dessous :
Représentaion de Lineweaver et Burk
L’avantage de cete représentaion c’est qu’elle permet d’obtenir les 2 constantes Vmax et Km à parir des 2 points d’inter-
secion de la droite respecivement avec l’axe des ordonnées et l’axe des abscisses.
5- Intérêt des constantes cinéiques
Elles fournissent les indices quanitaifs qui nous permetent de caractériser chaque enzyme.
− VM renseigne sur l’acivité de l’enzyme
− KM est inversement proporionnel à l’ainité pour le substrat.
− Kcat / Km mesure l’eicacité catalyique
B- CINÉTIQUE ALLOSTÉRIQUE
Les enzymes allostériques ne répondent pas aux cinéiques classiques de Michaëlis- Menten, mais à une courbe sigmoïde.
Cete courbe s’explique par le fait que la ixaion du S sur l’E augmente l’ainité de l’E pour le S. C’est l’efet coopéraif (les
sous-unités s’inluencent les unes les autres). Cet efet coopéraif est un phénomène homotrope posiif (homotrope : efet
d’un ligand sur sa propre ixaion).
La courbe en poinillés est obtenue en présence d’une concentraion élevée en A.
1 = KM x 1 + 1
vi VM [S] VM
Ce poly a ete telechargé depuis med-tmss.blogspot.com/2016/08/cours.html | Page Fb : www.facebook.com/Faculte.de.Medecine.TMSS](https://image.slidesharecdn.com/poly-pcem1-biochimiestructurale-bilogiecellulaire-161018085909/85/Poly-pcem1-biochimie-structurale-bilogie-cellulaire-125-320.jpg)

![ANNÉE UNIVERSITAIRE 2016-2017 / THEME II - LA CELLULE : STRUCTURE ET FONCTIONS - PCEM1 127
d- Les agents protecteurs du site acif.
Certains composés (glutathion, Vit C) protègent de l’oxydaion le groupement thiol des résidus de Cys réacifs au niveau du
site acif de certaines enzymes.
2-Les inhibiteurs
Il existe deux principaux types d’inhibiteurs enzymaiques. Les inhibiteurs irréversibles et les inhibiteurs réversibles.
a- Les inhibiteurs irréversibles.
Ils se lient de manière covalente à un groupement foncionnel indispensable à l’acivité catalyique. Exemples :
- Le di-isopropylluorophosphate (DFP) inhibe certaines protéases comme l’acétylcholinestérase en se ixant sur l’hydroxyle
d’un résidu sérine de leur site acif d’où son uilisaion comme gaz neurotoxique dans le cas de l’acétylcholinestérase.
- L’acide acétylsalycilique inhibe irréversiblement la cyclooxygénase par acétylaion d’un résidu sérine de son site acif.
Celle-ci iniie la synthèse des prostaglandines, médiateurs chimiques impliqués dans l’inlammaion, la douleur et la
ièvre.
b- Les inhibiteurs réversibles
Ils se ixent de manière non covalente à l’enzyme. On disingue :
- les inhibiteurs compéiifs
- les inhibiteurs non compéiifs
b1-Les inhibiteurs compéiifs
Ce sont des analogues structuraux du substrat. Ils se ixent au niveau du site acif à la place de celui-ci. Ainsi ils diminuent
l’ainité de l’enzyme pour le substrat en augmentant la Km. Ils ne modiient pas la Vmax puisque ces inhibiteurs peuvent
être déplacés du complexe ES par un excès de substrat.
Exemples :
- les sulfamides (médicaments anibactériens) sont des analogues structuraux de l’acide para-amino-benzoïque (PABA).
Celui-ci est un consituant de l’acide folique qui est un facteur de croissance pour de nombreuses bactéries.
- Le méthotrexate inhibe de manière compéiive la dihydrofolate réductase : enzyme qui réduit le DHF en THF. Le THF
sous sa forme méthylée (méthylène THF) paricipe à la biosynthèse du dTMP à parir du dUMP d’où l’inhibiion de la
réplicaion de l’ADN. C’est ainsi que le méthotrexate est uilisé comme ani métabolite en chimiothérapie anicancéreuse.
b2- Les inhibiteurs non compéiifs
Ils ne sont pas analogues structuraux du substrat. Ils se ixent en un site diférent du site acif, à la fois sur l’enzyme et sur
le complexe ES. C’est ainsi qu’ils ne diminuent pas l’ainité de l’enzyme pour le S mais diminuent la Vmax. Tout se passe
comme si la [Et] était diminuée.
Exemples : -CN, CO, SH2. Ces agents complexent le fer et le cuivre des systèmes enzymaiques respiratoires (cyto-
chrome-oxydase).
- Le luorure de sodium. Il se combine aux caions divalents. C’est ainsi qu’il inhibe les enzymes à Mg++(kinases), les en-
zymes à Mn++ (énolase). Il est uilisé comme aniglycolyique en vue d’un dosage diféré de la glycémie.
Représentaion de Lineweaver-Burk.
Diférence entre inhibiions compéiive et non compéiive.
Ce poly a ete telechargé depuis med-tmss.blogspot.com/2016/08/cours.html | Page Fb : www.facebook.com/Faculte.de.Medecine.TMSS](https://image.slidesharecdn.com/poly-pcem1-biochimiestructurale-bilogiecellulaire-161018085909/85/Poly-pcem1-biochimie-structurale-bilogie-cellulaire-127-320.jpg)

![ANNÉE UNIVERSITAIRE 2016-2017 / THEME II - LA CELLULE : STRUCTURE ET FONCTIONS - PCEM1 129
TEST D’AUTO-EVALUATION
Q 1. Vous inscrirez dans l’espace réponse prévu la ou les letre(s) correspondante à la ou aux proposiion(s) exacte(s) :
Une enzyme peut être déinie comme :
A- une protéine globulaire
B- un catalyseur spéciique
C- un biocatalyseur non obligatoire
D- un catalyseur sans acion en dehors des cellules
E- une substance consommée au cours de la réacion
F- une substance agissant à très faible concentraion
_________________________________________________________________________________________________
Q 2. a-Déinir les noions :
Proenzyme : ______________________________________________________________________________________
Isoenzyme: _______________________________________________________________________________________
Enzyme allostérique : _______________________________________________________________________________
b- Donner un exemple dans chaque cas.
_________________________________________________________________________________________________
_________________________________________________________________________________________________
_________________________________________________________________________________________________
Q 3. Vous inscrirez dans l’espace réponse prévu la ou les letre(s) correspondante à la ou aux proposiions exacte(s)
La VM :
A- représente vi à demi-saturaion des sites enzymaiques
B- déinit l’ainité de l’enzyme pour S
C- permet de déterminer AMS d’une enzyme
D- renseigne sur l’acivité catalyique des enzymes
E- est proporionnelle à la [E] en présence d’un excès de S
_________________________________________________________________________________________________
Q 4. Vous inscrirez dans l’espace réponse prévu la ou les letre(s) correspondante à la ou aux proposiions exacte(s)
La Km :
A- est proporionnelle à l’ainité de l’enzyme
B- représente la [S] permetant la saturaion des sites enzymaiques
C- peut être déterminée à parir des constantes de vitesses de la réacion enzymaique
D- peut être déterminée graphiquement selon la représentaion de lineweaver et Burk
E- renseigne avec Kcat sur l’eicacité catalyique
_________________________________________________________________________________________________
Q 5. On obient les résultats suivants pour une cinéique enzymaique de type michaëlien :
vi = 2 mM/mn pour [S]=5M
k1
= 5.103
, k-1
= 2,5.102
et kca t
= 1,25.102
a-calculer :
KM : ____________________________________________________________________________________________
VM: _____________________________________________________________________________________________
b-calculer AMS en sachant que la quanité d’enzyme uilisée est de 16,24 micromoles/L
AMS: ____________________________________________________________________________________________
Ce poly a ete telechargé depuis med-tmss.blogspot.com/2016/08/cours.html | Page Fb : www.facebook.com/Faculte.de.Medecine.TMSS](https://image.slidesharecdn.com/poly-pcem1-biochimiestructurale-bilogiecellulaire-161018085909/85/Poly-pcem1-biochimie-structurale-bilogie-cellulaire-129-320.jpg)









