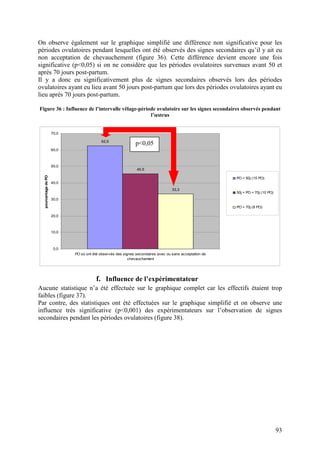
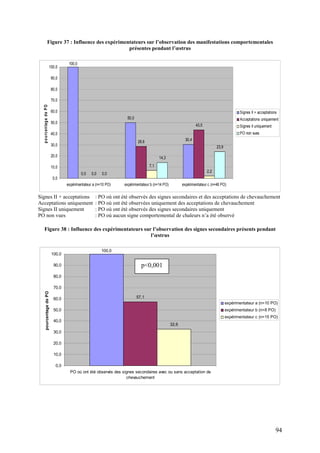
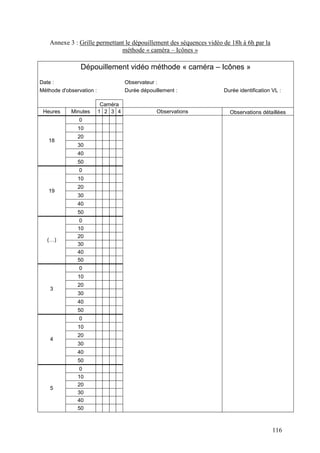
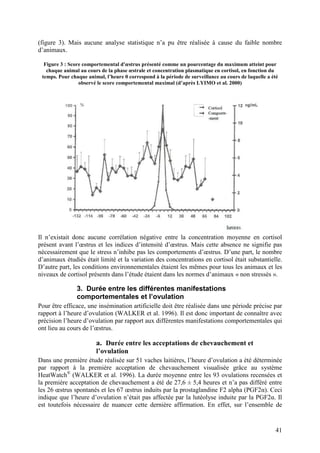
La thèse de Pierre Bruyère de l'École nationale vétérinaire de Lyon, soutenue en 2009, analyse les signes secondaires de chaleur chez la vache laitière à l'aide de vidéosurveillance. L'étude se concentre sur la détection de l'œstrus dans un élevage à Poisy, en comparant différentes méthodes d'observation et en évaluant l'influence de divers facteurs sur le comportement des vaches. Cette recherche vise à améliorer la détection des chaleurs pour optimiser la reproduction en élevage laitier.








































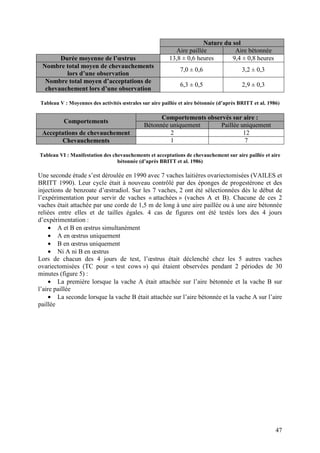
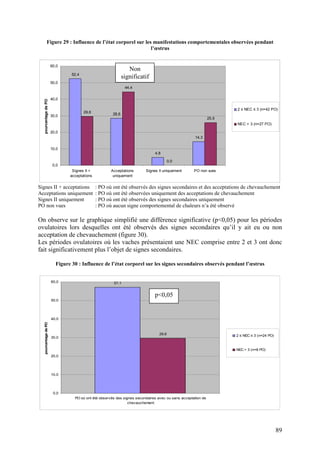
![Figure 4 : Profils de NEC identifiés en période post-partum (d’après PONSART et al. 2006)
Il s’est avéré que les pertes d’état supérieures ou égales à 1,5 étaient liées à un retard
d’apparition des premières chaleurs post-vêlage (57 jours pour une perte de moins de 1,5
point contre 69 pour une perte supérieure ou égale à 1,5 point).
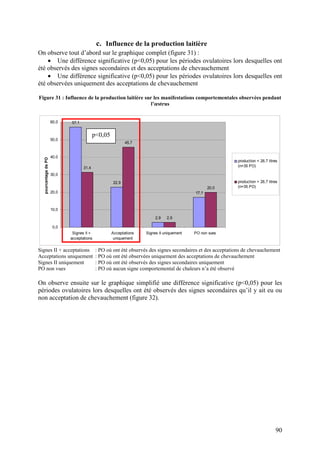
Une deuxième étude réalisée en 2006 a permis d’affiner ces résultats (PONSART et al.
2006b). Lors de cette étude, l’intervalle vêlage-premières chaleurs a été significativement
allongé pour une perte d’état supérieure ou égale à une point entre 0 et 30 jours post-partum
(p<0,005), et par une NEC insuffisante lors des premières chaleurs (p<0,05) (tableau IV).
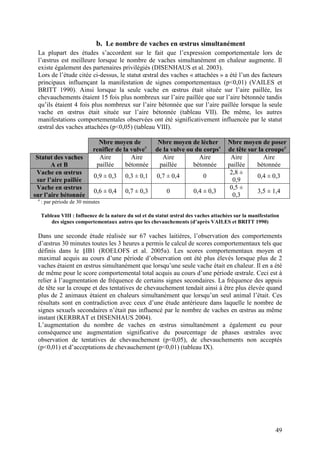
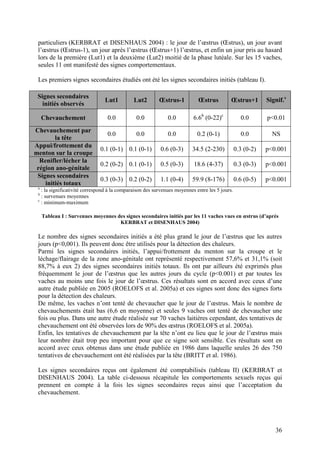
Intervalle vêlage-premières chaleurs Significativité
Perte de NEC entre 0 et < 1 point 57 ± 4 jours
p<0,005
30 jours post-partum ≥ 1 point + 8 jours
≥ 2,5 54 ± 4 jours
NEC aux premières
]1,5 - 2,5[ + 5 jours p<0,05
chaleurs
≤ 1,5 + 16 jours
Tableau IV : Influence de la perte d’état corporel entre 0 et 30 jours post-partum et de la NEC lors des
premières chaleurs sur l’intervalle vêlage-premières chaleurs (d’après PONSART et al. 2006)
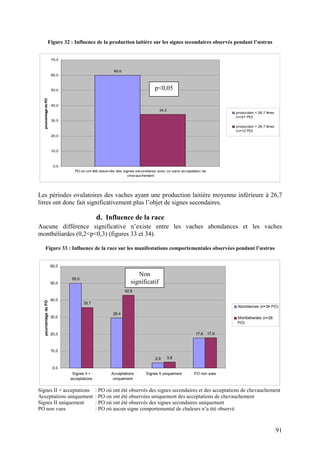
e. L’intervalle entre le vêlage et la période ovulatoire
Dans une étude réalisée sur 13 vaches ovariectomisées, les signes comportementaux ont été
observés lors de 6 œstrus déclenchés successifs (BRITT et al. 1986). Les premiers œstrus ont
eu lieu en moyenne à 54 jours post-partum et les derniers à 194 jours post-partum. Le nombre
total de chevauchements a été significativement différent (p<0,01) entre les 6 périodes
œstrales successives : de 2,6 ± 0,6 lors de la première à 6,9 ± 1,0 lors de la dernière. Aucun
autre signe comportemental n’a été influencé par le rang de l’œstrus. Ces résultats sont
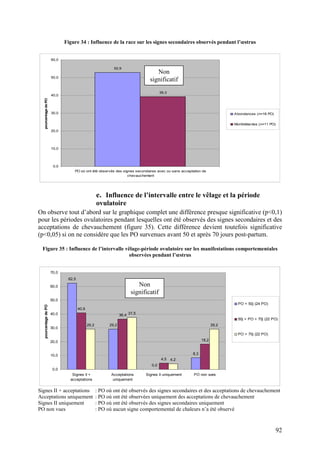
concordants avec ceux d’une autre étude dans laquelle les premières ovulations post-partum
ont été significativement moins associées à des manifestations comportementales que les
deuxième ou troisième ovulations post-partum (34,4% contre 71,9% et 83,3%, p<0,01)
(NEBEL et MCGILLIARD 1993b). On peut remarquer que, dans cette dernière étude, les
vaches utilisées étaient toutes en balance énergétique négative.
Par ailleurs, le nombre d’acceptations de chevauchement ainsi que leur durée sont plus faibles
45](https://image.slidesharecdn.com/2009lyon010-120603090224-phpapp02/85/2009lyon010-45-320.jpg)