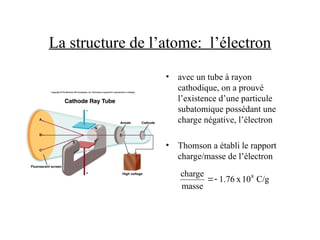
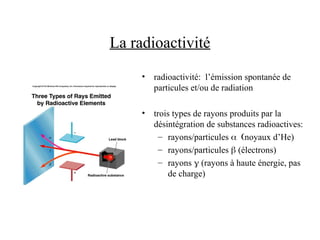
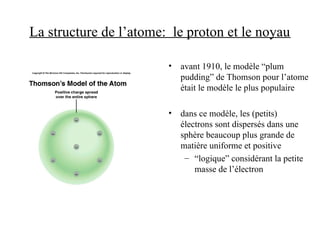
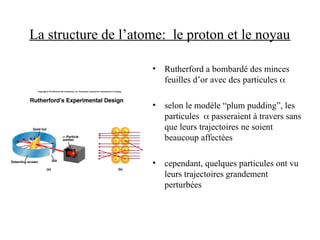
Le document traite de la théorie atomique de Dalton, la découverte des électrons par Thomson, et le modèle atomique de Rutherford qui illustre la structure des atomes avec les protons et les neutrons. Il décrit également les isotopes, la formation de molécules et ions, ainsi que la nomenclature des composés inorganiques, y compris les acides et les bases. Enfin, il aborde le tableau périodique et les propriétés des éléments et composés chimiques.