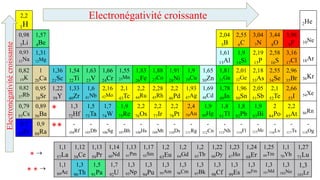
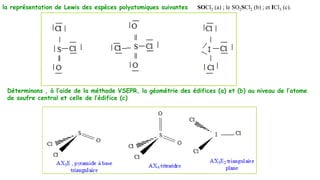
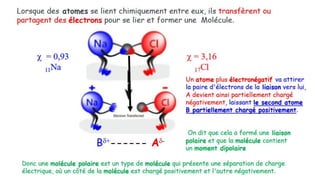
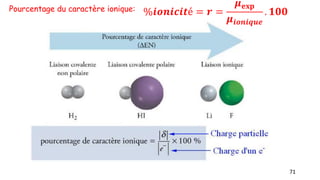
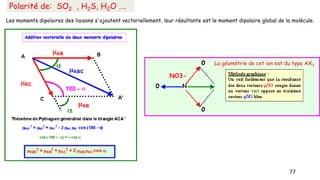
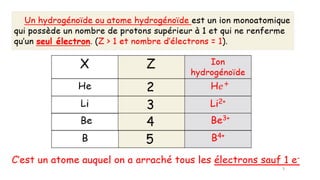
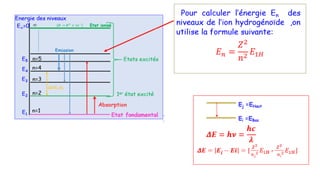
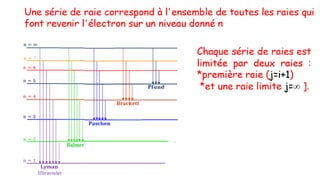
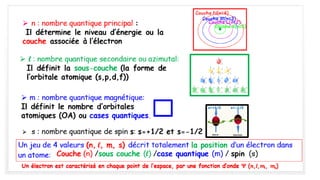
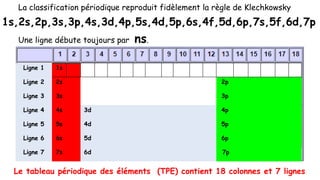
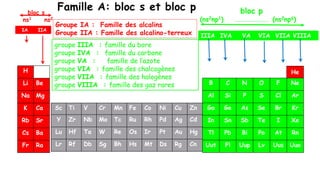
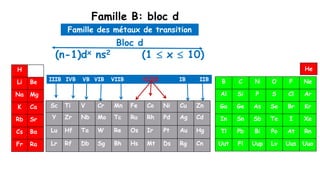
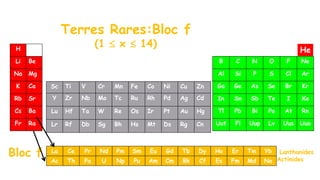
Le document traite de l'atomistique et de la liaison chimique, détaillant les calculs des niveaux d'énergie de l'atome d'hydrogène et des transitions électroniques. Il aborde également la structure électronique, la configuration des atomes selon la règle de Klechkowski, ainsi que les différences entre les propriétés paramagnétiques et diamagnétiques des éléments. Des exemples sont fournis pour illustrer comment les éléments chimiques sont classés dans le tableau périodique selon leur structure et leurs caractéristiques électroniques.











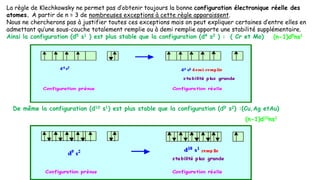
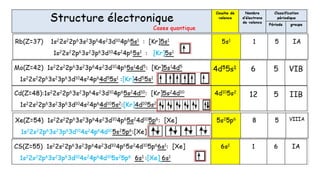
![Rb(Z=37) 1s22s22p63s23p64s23d104p65s1 : [Kr]5s1
1s22s22p63s23p63d104s24p65s1 : [Kr]5s1
5s1 1 5 IA
Structure électronique
Cases quantique
Couche de
valence
Nombre
d’électrons
de valence
Classification
périodique
Période groupe
Cd(Z=48):1s22s22p63s23p64s23d104p65s24d10: [Kr]5s24d10
1s22s22p63s23p63d104s24p64d105s2:[Kr]4d105s2
4d105s2
12 5 IIB
Xe(Z=54) 1s22s22p63s23p64s23d104p65s24d105p6: [Xe]
1s22s22p63s23p63d104s24p64d105s25p6:[Xe]
5s25p6 8 5 VIIIA
CS(Z=55) 1s22s22p63s23p64s23d104p65s24d105p66s1: [Xe]
1s22s22p63s23p63d104s24p64d105s25p6 6s1 :[Xe] 6s1
6s1 1 6 IA](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-26-320.jpg)
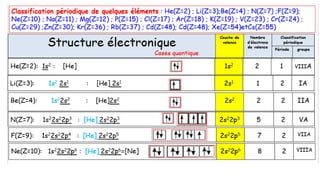
![Cr(Z=24) : 1s22s22p63s23p64s13d5 :[Ar]4s13d5
1s22s22p63s23p63d54s1: [Ar]3d54s1
3d54s1 6 4 VIB
Structure électronique
Cases quantique
Couche
de
valence
Nombre
d’électrons
de valence
Classification
périodique
Période groupe
Mo(Z=42) : 1s22s22p63s23p64s23d104p65s14d5: [Kr]5s14d5
1s22s22p63s23p63d104s24p64d55s1 :[Kr]4d55s1
4d55s1
6 5 VIB
Cu(Z=29) : 1s22s22p63s23p64s13d10 : [Ar]4s13d10
1s22f.s22p63s23p63d104s1 : [Ar]3d104s1
3d104s1 11 4 IB
Ag(Z=47) : 1s22s22p63s23p64s23d104p65s14d10 :[Kr] 5s14d10
1s22s22p63s23p63d104s24p64d105s1: [Kr] 4d105s1
4d105s1 11 5 IB
Au(Z=79): 1s22s22p63s23p64s23d104p65s24d105p66s14f145d10
[Xe] 6s1 4f14 5d10
[Xe] 4f14 5d10 6s1
5d106s1 11 6 IB
Les éléments qui font exception à la règle de Klechköwsky :](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-28-320.jpg)
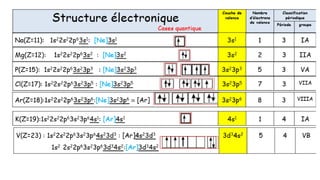



![Potassium K(Z=19) : 1s22s22p63s23p64s1
Électron de cœur : 1s22s22p63s23p6
Électron de valence : 4s1
Groupes de Slater : (1s2) (2s22p6) (3s23p6) (4s1)
𝑬𝒏 =
𝒁
∗𝟐
𝒏∗𝟐
𝑬𝟏𝑯
𝒁𝒊
∗
= 𝒁 − 𝝈𝒋→𝒊
Des électrons d’un même groupe « ressentent » la même charge effective.
Ils ont donc une même énergie et sont à la même distance du noyau.
[1s] [2s ,2p] [3s ,3p] [4s,4p]
Z=19 2e- 8e- 8e- 1e-](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-40-320.jpg)

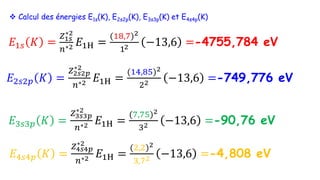


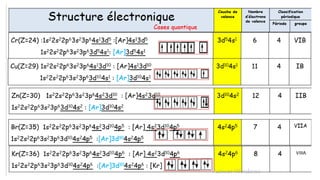
![Fe(Z=26 ; 26 e-)1s2 2s2 2p6 3s2 3p6 3d6 4s2
En cas d’ionisation ce sont les e- (4s) qui partent avant les e- (3d)
En cas d’ionisation des éléments du bloc d , ils perdront d’abord deux
électrons s avant de perdre ,éventuellement , un ou plusieurs de leurs
électrons d.
Fe+ (Z=26 ; 25 e-)
Fe2+ (Z=26 ; 24 e-)
Fe3+ (Z=26 ; 23 e-)
1s2 2s2 2p6 3s2 3p6 3d6 4s1
1s2 2s2 2p6 3s2 3p6 3d6
1s2 2s2 2p6 3s2 3p6 3d5
Zn(Z=30) 1s22s22p63s23p64s23d10 : [Ar] 4s23d10 :(RD)
1s22s22p63s23p63d104s2 : [Ar] 3d104s2 :(DS)
Formation de l’ion Zn2+
:1s22s22p63s23p63d10 : [Ar] 3d10](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-45-320.jpg)
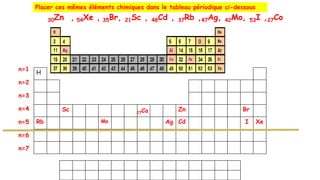
![Le molybdène (Mo) appartient à la famille du chrome Cr (Z=24) et à la 5ème période.
1. Donner sa structure électronique selon la règle de Klechkowsky et selon la disposition
spatiale ainsi que son numéro atomique.
2. Le molybdène appartient-il aux métaux de transition ? Justifier votre réponse.
3. Quels sont les propriétés magnétiques du molybdène quand il est isolé ?
2) Mo présente les orbitales s et d comme orbitales de valence, ils appartiennent donc au bloc d :
Mo est un métal de transition
3) Mo est paramagnétique car il présente des électrons célibataires
1) Cr(Z=24) :1s22s22p63s23p64s13d5 :[Ar]4s13d5
Mo appartient donc à la période n=5 et à la famille VIB (ns1(n-1)d5), sa configuration
électronique de valence sera alors 5s14d5
1s22s22p63s23p63d104s24p64d55s1
Mo : 1s22s22p63s23p64s23d104p65s14d5](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-46-320.jpg)



![Calcul de la charge nucléaire effective Z* perçue par chaque électron de
l’atome de chlore Cl (Z=17, 17 électrons)
Cl
[1s2] [ 3s2 ; 3p5]
+17
Cl (Z=17, 17électrons) : 1s22s22p63s 23p5 configuration électronique à l’état fondamental
Électron de cœur : 1s22s22p6
Électron de valence :3s23p5
Groupes de Slater : (1s2) (2s22p6) (3s23p5)
[2s2 ; 2p6 ]
𝒁𝒊
∗
= 𝒁 − 𝝈𝒋→𝒊](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-50-320.jpg)
![Calcul des charges nucléaires effectives Z*
1s(Cl), Z*
2s2p(Cl) et Z*
3s3p(Cl)
7
,
16
30
,
0
17
1
1
)
(
1
s
s
Z
Cl
s
Z
85
,
12
15
,
4
17
)]
85
,
0
(
2
)
35
,
0
(
7
[
17
2
2
1
2
2
2
2
2
7
)
(
2
2
p
s
s
p
s
p
s
Z
Cl
p
s
Z
1
,
6
9
,
10
17
)
(
3
3
)]
1
(
2
)
85
,
0
(
8
)
35
.
0
(
6
[
17
)
(
3
3
3
3
1
2
3
3
2
2
8
3
3
3
3
6
)
(
3
3
Cl
p
s
Z
Cl
p
s
Z
p
s
s
p
s
p
s
p
s
p
s
Z
Cl
p
s
Z
𝒁𝒊
∗
= 𝒁 − 𝝈𝒋→𝒊](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-51-320.jpg)



![EI1 = E(Cl+) - E(Cl)
EI1 = [2E1s(Cl+) + 8E2s2p(Cl+) + 6E3s3p(Cl+)] - [2E1s(Cl) + 8E2s2p(Cl) + 7E3s3p(Cl+)]
Calculons
3 3 3 3 3 3 2 2 3 3 1 3 3
( ) 5 8 2
17 5(0,35) 8 . 0,85 +2(1)
6,45
s p s p s p s p s p s s p
Z Cl Z
*2 2
( ) (6,45)
3 3
( ) ( ) ( 13,6) 62,866
3 3 1
2 2
(3)
Z Cl
s p
E Cl E eV
s p H
n
EI1 = 6E3s3p(Cl+
) - 7E3s3p(Cl)
E3s3p(Cl) = - 56,23 eV
EI1(Cl) = 6E3s3p(Cl+
) - 7E3s3p(Cl) = 6 (-62,866) – 7 (-56,23)
= - 377,196 + 393,61 = 16,414 eV](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-55-320.jpg)


![Be [1s2] [2s2]
E1 E2 EBe = 2 E1 + 2 E2
Be+ [1s2] [2s1]
E1 E'2 EBe
+ = 2 E1 + E'2
E.I1 = EBe
+ - EBe = E'2 - 2 E2
Be2+ [1s2]
E1 EBe
2+ = 2 E1
E.I2 = EBe
2+ - EBe
+ = -E'2
Be3+ [1s1]
E'1 EBe
3+ = E'1
E.I3 = EBe
3+ - EBe
2+ = E'1 - 2 E1
Be4+ EBe
4+ = 0
E.I4 = EBe
4+ - EBe
3+ = -E'1
Structure électronique Energie de l’élément X Energie d’ionisation](https://image.slidesharecdn.com/resumeetudiants-240208093151-c7b2dfa1/85/Resume-Etudiants-pdf-ATOMISTIQUE-COMPLET-58-320.jpg)