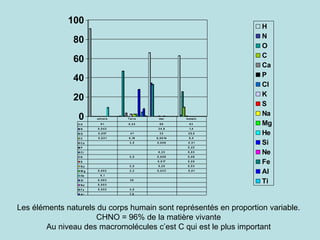
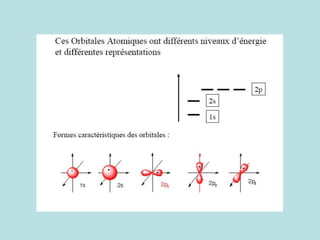
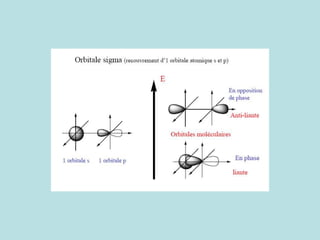
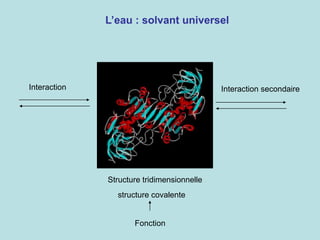
Le document traite de la biochimie et de la composition des organismes vivants, soulignant l'importance des éléments chimiques comme le carbone, l'hydrogène, l'oxygène et l'azote. Il explique la hiérarchie des structures biologiques, des atomes aux macromolécules, et décrit le processus qui a conduit à l'apparition des molécules organiques dans les océans primordiaux. Enfin, il aborde les interactions chimiques, notamment les liaisons covalentes et la chimie de l'eau comme solvant universel pour les molécules biologiques.