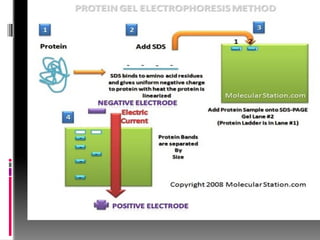
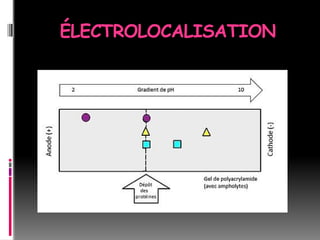
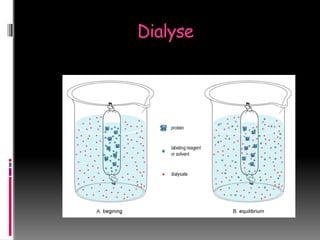
Le document décrit les méthodes d'étude des protéines, comprenant l'isolement, l'analyse chimique, la détermination de la structure et la relation entre structure et fonction. Il détaille diverses techniques comme la chromatographie, l'électrophorèse et la purification des protéines ainsi que leurs principes et applications. Différentes méthodes de dosage des protéines sont également présentées, incluant la spectrophotométrie et des réactions colorimétriques.