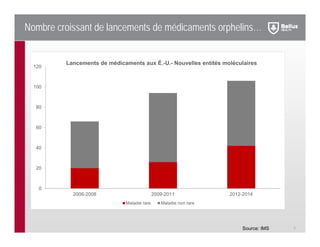
La présentation de Bellus Santé inc. aborde les énoncés prospectifs et les risques associés à leur développement de médicaments pour les maladies rares, notamment au sujet de leur produit phare, kiactamc, destiné à traiter l'amylose AA. Ils prévoient d'atteindre des étapes majeures en 2016 avec des résultats prometteurs et une stratégie de partenariats pour la validation clinique. Malgré des ventes potentielles élevées, l'entreprise met en garde contre la dépendance à des facteurs externes qui pourraient influencer leurs résultats futurs.











![14
KIACTAMC – Résultats de la phase II/III
Résultats de la phase 2/3 publiés dans
le New England Journal of Medicine:
• Réduction de 42 % du risque (p=0.025)
d’événements de détérioration de la fonction
rénale pour les patients sur KIACTAMC
• “Les bienfaits [de Kiacta] sont significatifs sur
le plan clinique et ont pu être observés tôt au
cours du traitement”
Entente conclue aux É.-U., en
Europe et au Japon pour mener une
étude de validation de phase III
• Approbation fondée sur l’atteinte de
résultats comparables à la première
étude de phase III](https://image.slidesharecdn.com/agm2015-presentationfrfinal-150512142011-lva1-app6891/85/Presentation-de-la-direction-May-2015-14-320.jpg)











