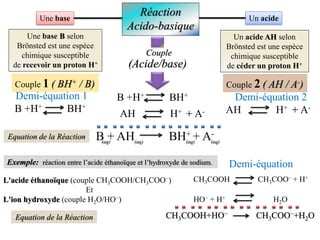
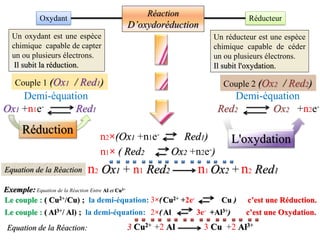
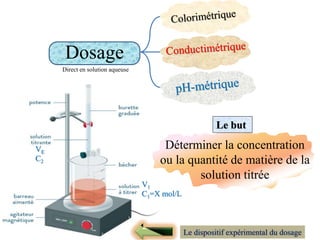
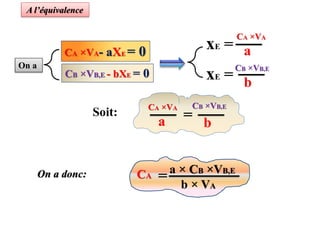
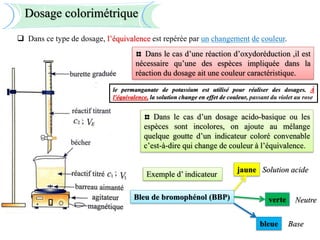
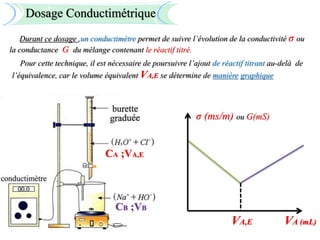
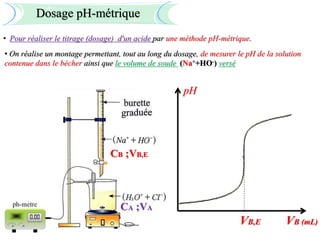
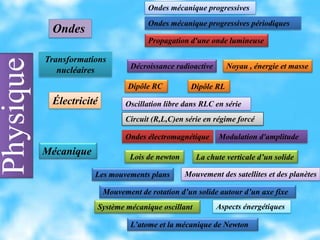
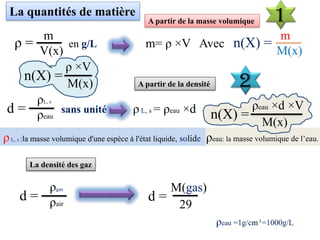
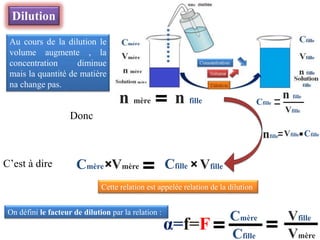
Le document aborde divers concepts de chimie et de physique tels que les ondes mécaniques, la radioactivité, les réactions chimiques, la concentration des solutions, et la conductivité. Il inclut des équations et des lois fondamentales, ainsi que des exemples de dosages acido-basiques et d'oxydoréduction. Les informations sont présentées de manière détaillée pour aider à la révision pour le bac.

![Quelques rappels importants sur les quantités de matière
n(X) =
M(X)
m Solide.
Liquide.
Gaz .
-X: espèce chimique: molécule, atome, électron……
-m: la masse en gramme.
-M(X): la masse molaire{atomique/molaire} en g mol-1
n(X) =
NA
N(x) -NA: la constante d’Avogadro = 6,02.1023 mol-1
-N(x): le nombre d’entité chimique.
n(X) =
Vm
V(x) Gaz
-Vm: le volume molaire en L. mol-1 .
-V(x): le volume de l’espèce chimique en L.
n(X) = C×V
n(X) = [X] × V
-C: la concentration molaire en soluté apporté d'une
solution en mol.L -1..
-[X]: la concentration molaire effective des espèces
présents dans les solutions en mol.L -1.
Solution
aqueuse
n(X)=
R × T
P(x)×V(x) - P: la pression en pascal.(Pa)
- V: le volume en m3 .
-T: la température en °K. {T(en K)=T(en°C)+273}
- R: la constante des gaz parfait en J.mol-1.K-1
R=8,314 J.mol-1.K-1
Les gaz
parfaits
Solide.
Liquide.
Gaz .
L’état physique
de l’espèce chimique](https://image.slidesharecdn.com/priodedervision2bac-241213215902-2e97ffcf/85/Periode-de-revision-2-BAC-pdf-2bac-terminale-4-320.jpg)
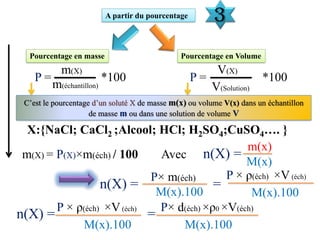
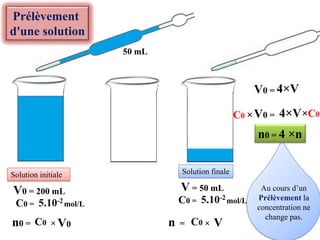
![La concentration
La concentration molaire en soluté apporté d'une solution ou concentration molaire d’une
solution notée C s’exprime par :
C =
Vs
n(Soluté) En mol/L
La concentration molaire effective d’une espèce chimique X en solution notée [X]
s’exprime par :
[X] =
Vs
n(X) En mol/L
La concentration massique ( ou teneur , titre massique ) de un soluté dissout dans une
solution aqueuse notée Cm s’exprime par :
Cm =
Vs
m En g/L
Cm = C×M(X)
La relation entre la concentration molaire d’une solution C et la concentration
massique Cm.](https://image.slidesharecdn.com/priodedervision2bac-241213215902-2e97ffcf/85/Periode-de-revision-2-BAC-pdf-2bac-terminale-7-320.jpg)
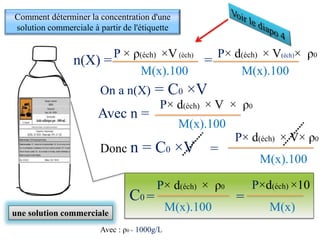


![s’obtient en examinant le nombre stœchiométrique
devant l’ion X dans l’équation de la réaction de dissolution.
[X]= (le nombre stœchiométrique) ×C
Al + Cl
1
Al Cl3
3+ -
Eau
(aq) (aq)
3
Exemples
[Cl -]= 3 ×C ; [Al 3+]= 1 ×C
( )
Solution de chlorure d'aluminium de
concentration C et de volume V
V
n (Cl -)
[Cl -]= = = 3 × C
V
3 × C ×V
V
n (Al 3+)
[Al 3+]= = = 1 × C
V
1 ×C ×V
La relation entre la concentration molaire d’une solution C et la concentration
effective [X] d’un ion X](https://image.slidesharecdn.com/priodedervision2bac-241213215902-2e97ffcf/85/Periode-de-revision-2-BAC-pdf-2bac-terminale-15-320.jpg)
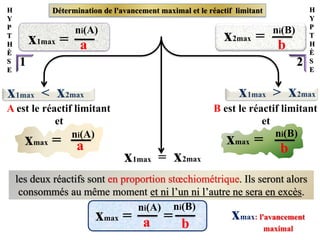
![Attention La concentration effective des ions dans
le cas d’un mélange de plusieurs solutions
Solution 1 (2Al 3++3 So4
2- )
de sulfate d'aluminium
C1 et V1
Solution 2 (Cu2++So4
2- )
de sulfate de cuivre
C2 et V2
le volume total
VT =V1+V2
Les espèces ioniques présents dans le mélange: Al 3+et Cu2+, So4
2-
VT
n2 (Cu 2+)
[Cu 2+]= =
VT
1 × C2 ×V2
VT
n1(Al 3+)
[Al 3+]= =
VT
2 ×C1 ×V1
[So4
2-]= = =
n (So4
2-)
VT
n1(So4
2-)+n2(So4
2-)
VT VT
3×C1 ×V1 +1 × C2 ×V2](https://image.slidesharecdn.com/priodedervision2bac-241213215902-2e97ffcf/85/Periode-de-revision-2-BAC-pdf-2bac-terminale-16-320.jpg)
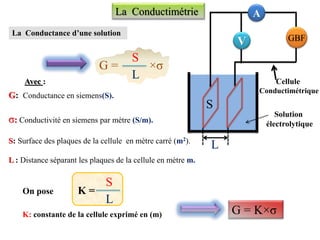
![b+ a-
A + B
A B Eau
a b
a b
(aq) (aq)
(s)
Pour une solution électrolytique (aAb++bBa-) de concentration molaire C
La conductivité de la solution
s’exprime par: σ = λAb+×[Ab+]+λBa-×[Ba-]
λAb+; λBa-: La conductivité molaire ionique exprimée en (S.m2.mol-1)
[Ab+];[Ba-]:les concentrations molaires effectives des ions A et B
On sait que : [Ab+] = a ×C et [Ba-] = b ×C
La conductivité de la solution
σ = λAb+×a×C+λBa-×b×C Attention à
l’unité de C
en mol/ m3
Avec
σ = (λAb+×a+λBa-×b)×C
mol/ m3
mol/ L
×103
×10-3](https://image.slidesharecdn.com/priodedervision2bac-241213215902-2e97ffcf/85/Periode-de-revision-2-BAC-pdf-2bac-terminale-18-320.jpg)