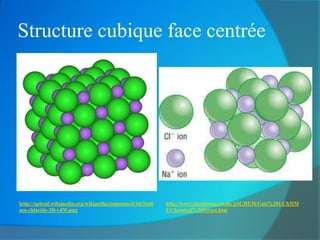
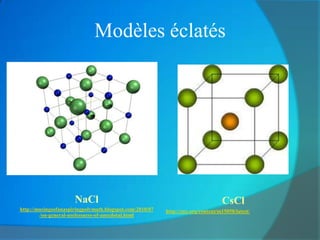
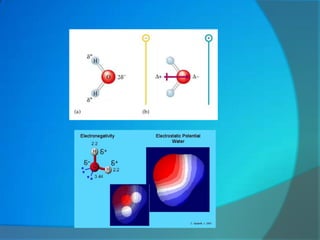
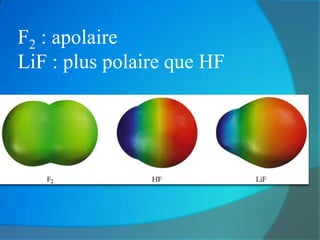
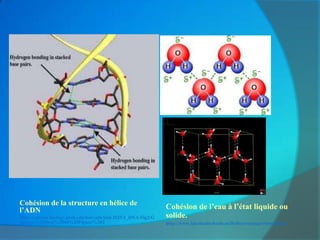
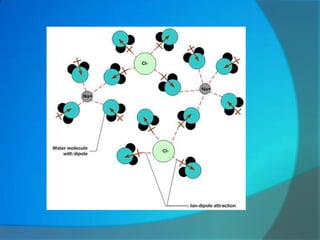
Le document traite de la cohésion de la matière en chimie, en détaillant les solides ioniques et moléculaires, leur structure, et les interactions qui les lient. Il explique également la conservation de la matière lors de la dissolution et les transformations physiques liées au transfert thermique, en présentant des concepts tels que la capacité thermique et les changements d'état. Enfin, il aborde les liaisons chimiques, la polarité des molécules et les principes de solubilité.



















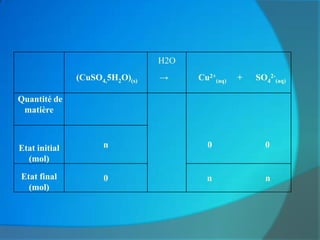

![ Concentration apportée
La concentration apportée en soluté est
égale à la quantité de matière de soluté
divisée par le volume de solution à l’instant
initial de la dissolution.
Notation
La concentration molaire d’un ion est notée
[ion]. Exemple :
n(SO42-) / V = [SO42-]](https://image.slidesharecdn.com/cohsionchimiquecoursakto-docx-120304120818-phpapp02/85/Cohesion-chimique-cours_akto-docx-31-320.jpg)