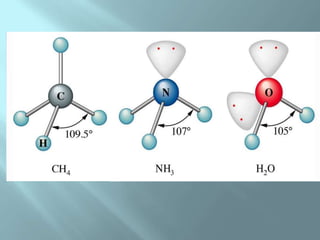
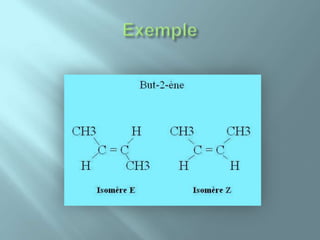
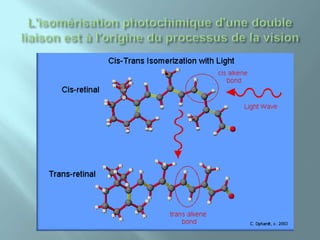
Le document traite de la structure et du comportement des atomes et des molécules, y compris la configuration électronique, la formation d'ions et de molécules, ainsi que la représentation de Lewis. Il décrit également les doublets d'électrons, leurs géométries associées et les implications de la structure moléculaire sur la couleur des composés. Enfin, il aborde la synthèse d'une molécule organique colorée et les observations de sécurité nécessaires lors des manipulations chimiques.