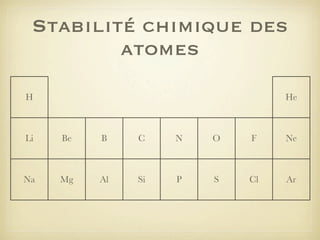
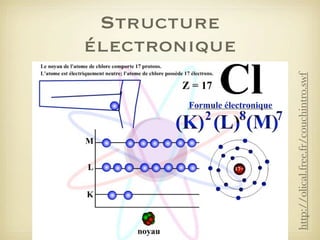
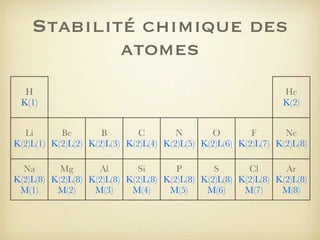
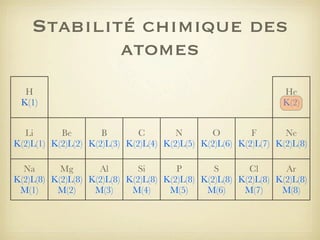
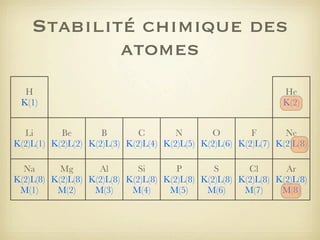
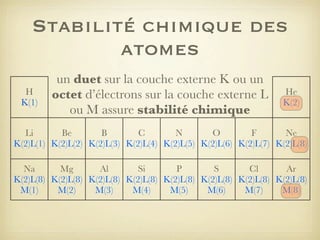
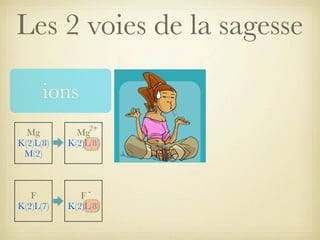
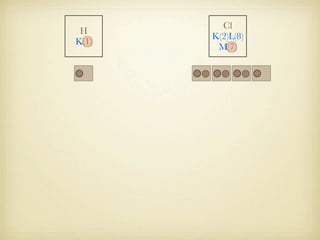
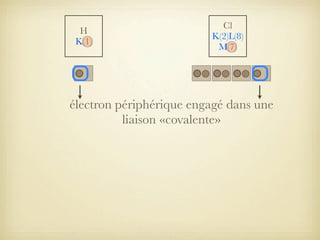
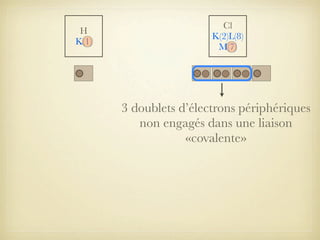
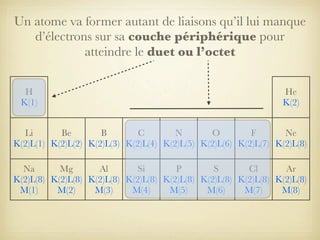
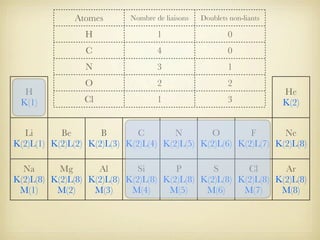
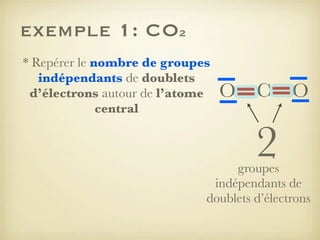
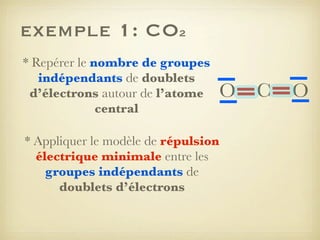
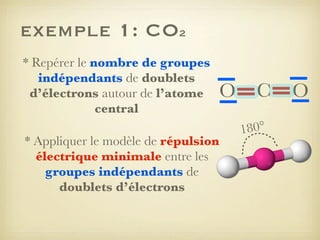
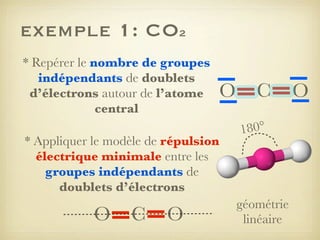
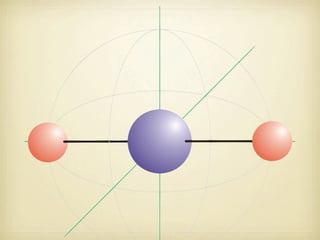
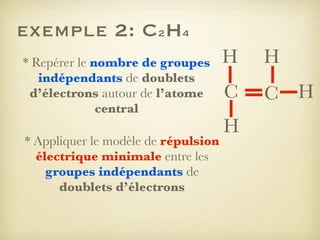
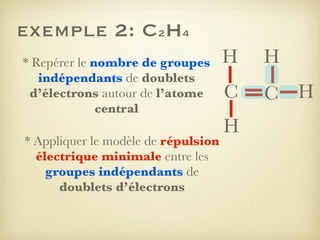
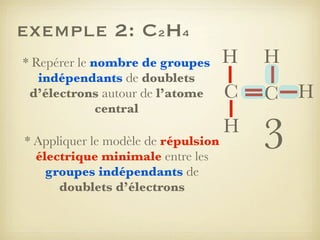
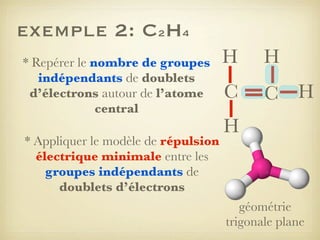
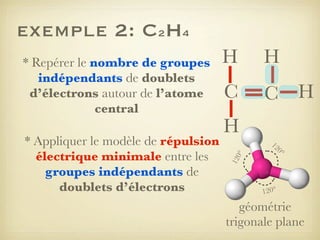
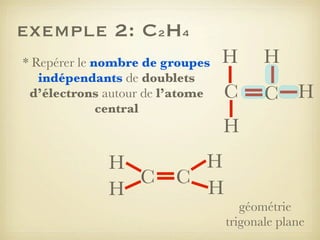
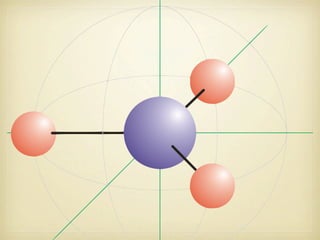
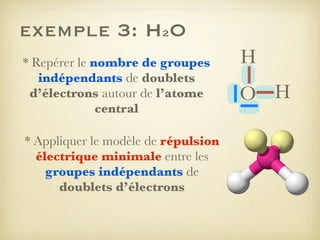
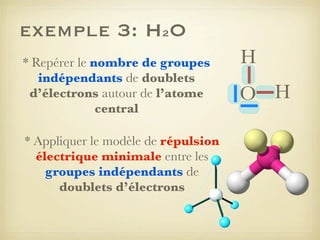
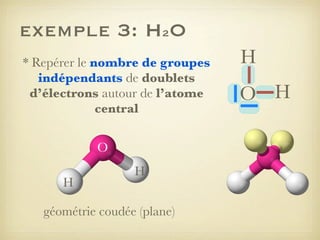
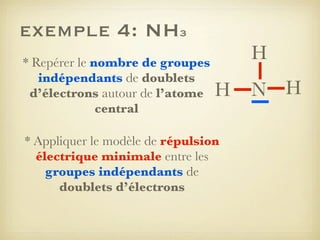
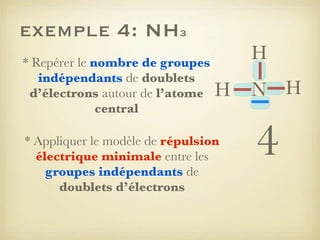
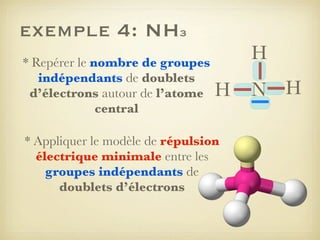
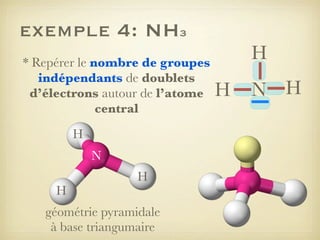
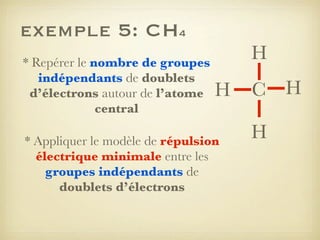
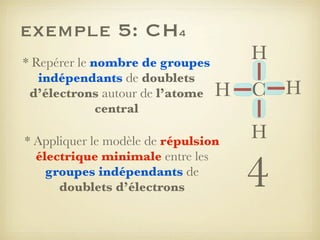
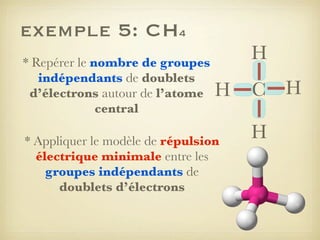
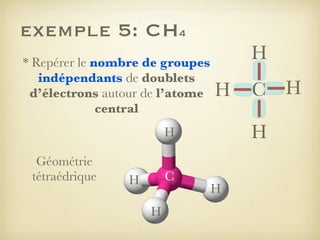
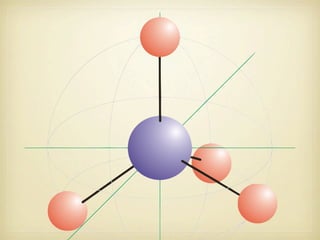
Le document aborde la formation et la géométrie des molécules, ainsi que la stabilité chimique des atomes en fonction de leur structure électronique. Il décrit des concepts tels que le duet et l'octet, les doublets liants et non-liants, ainsi que les géométries moléculaires selon le modèle VSEPR. Plusieurs exemples illustrent les principes de géométrie moléculaire pour différentes molécules comme CO2, C2H4, H2O, NH3, et CH4.