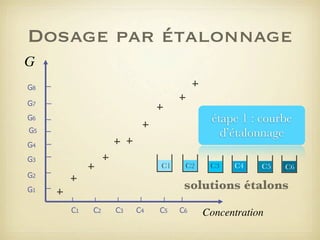
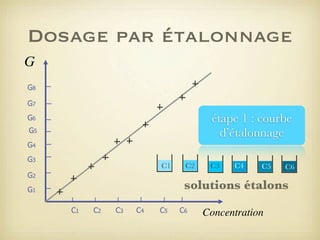
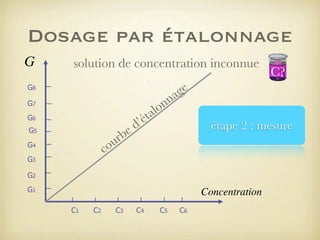
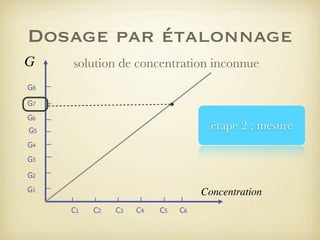
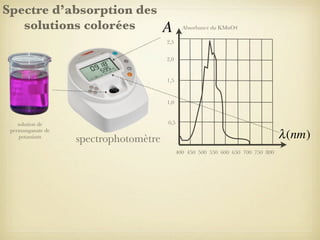
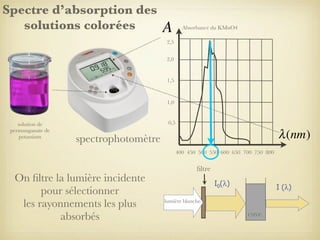
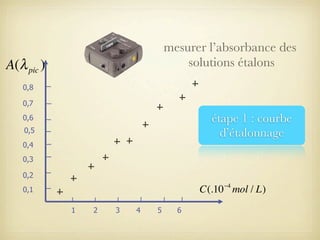
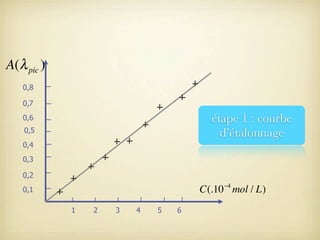
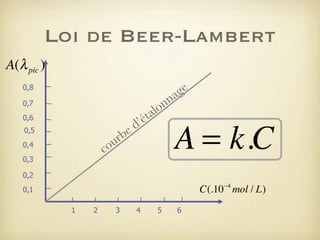
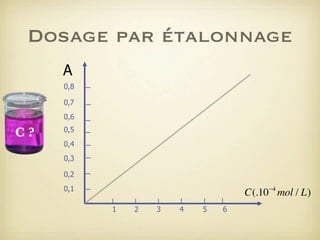
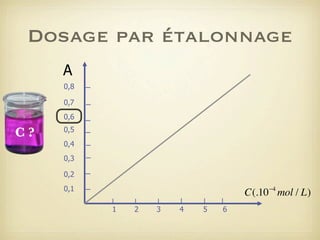
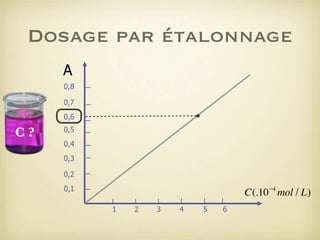
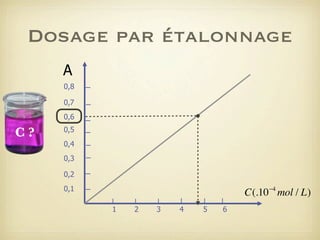
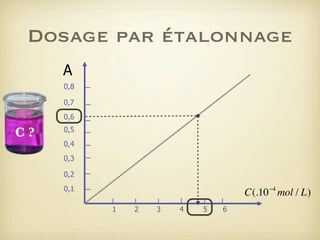
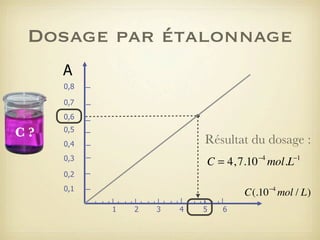
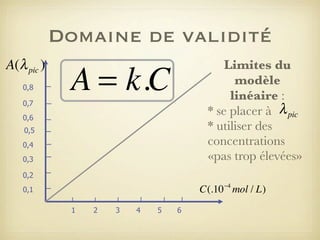
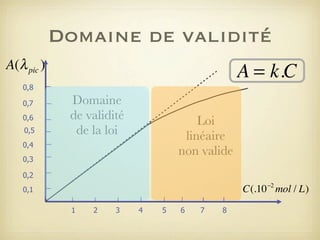
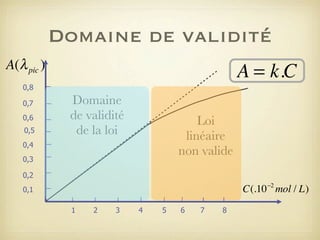
Le document traite du dosage par étalonnage spectrophotométrique, mettant en avant la méthode pour déterminer la concentration d'une espèce en solution à l'aide d'une courbe d'étalonnage. Il présente notamment la loi de Beer-Lambert et les étapes pour mesurer l'absorbance des solutions colorées. Des alternatives de dosage, comme le titrage chimique et conductimétrique, sont également mentionnées.