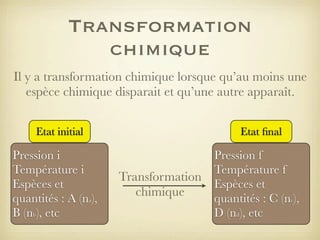
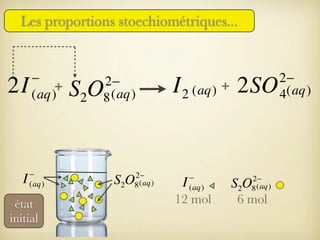
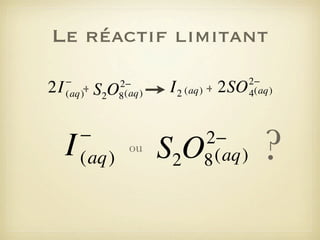Le document traite des transformations chimiques, en se concentrant sur les réactions entre ions iodures et peroxodisulfates. Il présente une modélisation de la réaction à l'aide d'équations bilans et explique la conservation des éléments et des charges. De plus, il aborde la notion de réactif limitant et comment déterminer l'évolution d'un système chimique.