Le document traite de l'autoprotolyse de l'eau, expliquant les notions de concentrations en ions H3O+ et OH-, ainsi que la constante d'équilibre Kw. Il aborde également les couples acide/base, les réactions acido-basiques, et la mesure du pH en fonction des concentrations d'ions. Enfin, il souligne l'importance de la température sur la constante Kw et les implications sur les pH des solutions.



![4
L’autoprotolyse de l’eau
Compléter le tableau suivant pour une solution aqueuse.
[H3O+] / mol L-1 10-5 4.10-9
[OH-] / mol L-1 10-5 5.10-10
Milieu neutre acideacide
10-9
basique
10-9
basique
2,5.10-6
acide
2.10-5 10-7
10-7
10-1 ?
10-13 ?
T 0 °C 25 °C 50 °C 75 °C 100 °C
Kw 0,112.10-14 1,023.10-14 5,495.10-14 19,95.10-14 56,23.10-14
La constante Kw dépend significativement de la température :
La réaction d’autoprotolyse de l’eau est-
elle endothermique ou exothermique ?
Combien d’ions [H3O+] peut-on dénombrer dans un litre d’eau (masse 1 kg) à 25 °C ?
A quel pourcentage du total des particules cela correspond-il ?
endothermique
Avec une concentration molaire de 10-7 mol/L, il y a 10-7.6.1023 = 6.1016 ions par litre d’eau.
1 kg d’eau correspond à 1000/18 = 55,6 moles d’eau soit 55,6.6.1023 = 3,3.1025 molécules.
Pourcentage : 100.6.1016/3,3.1025 ≈ 0,0000002 % ce qui correspond à environ 1 ion pour 600 millions de molécules.](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-4-320.jpg)


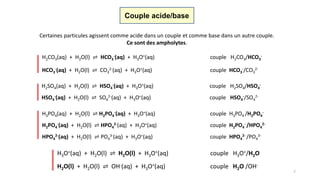


![10
Classification des acides et des bases
Tout comme l’eau sert de référence à la mesure de la force des acides et des
bases, les deux couples associés à l’eau servent à classer les acides et les bases.
H3O+(aq) + H2O(l) ⇌ H2O(l) + H3O+(aq) couple H3O+/H2O Ka = [H3O+]/[H3O+] = 1,00
H2O(l) + H2O(l) ⇌ OH-(aq) + H3O+(aq) couple H2O /OH- Ka = [H3O+].[OH-] = 10-14
HCl/Cl-Na+/NaOH
Les acides et bases forts sont (quasi) totalement dissociés.](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-10-320.jpg)
![11
Les réactions acido-basiques
Deux couples acide/base (autres que l’eau) sont mis en jeu.
L’objectif est de déterminer la constante d’équilibre (Kc) de ces réactions.
Ka1 = [Base1].[H3O+]/[Acide1]
Ka2 = [Base2].[H3O+]/[Acide2]Acide1(aq) + Base2(aq) ⇌ Base1(aq) + Acide2(aq)
H+ H+
𝐾𝑐 =
𝐵𝑎𝑠𝑒1 . 𝐴𝑐𝑖𝑑𝑒2
𝐴𝑐𝑖𝑑𝑒1 . 𝐵𝑎𝑠𝑒2
=
𝐵𝑎𝑠𝑒1 . 𝐴𝑐𝑖𝑑𝑒2
𝐴𝑐𝑖𝑑𝑒1 . 𝐵𝑎𝑠𝑒2
∙
𝐻3 𝑂+
𝐻3 𝑂+
=
𝐾 𝑎1
𝐾 𝑎2
Les constantes d’acidité permettent de calculer les
constantes d’équilibre des réactions acido-basiques.
Attention de ne pas confondre le numérateur et le dénominateur !](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-11-320.jpg)

![13
Le pH des solutions aqueuses
Comme les concentrations en ions H3O+(aq) et OH-(aq) rencontrées en pratique
sont petites, comprises entre 1 mol/L et 10-14 mol/L, il est usuel de travailler avec
le logarithme décimal (changé de signe) de ces concentrations.
pH = - log [H3O+]
L’opérateur : – log(grandeur) = p(grandeur) a été généralisé.
pOH = - log [OH-] pour l’eau pure à 25 °C , [H3O+] = [OH-] = 10-7 → pH = pOH = 7
pKa = - log Ka pKb = - log Kb pNa = - log [Na+] …](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-13-320.jpg)
![14
Le pH des solutions aqueuses
T 0 °C 25 °C 50 °C 75 °C 100 °C
Kw 0,112.10-14 1,023.10-14 5,495.10-14 19,95.10-14 56,23.10-14
La constante Kw dépend significativement de la température :
Quel est le pH de neutralité
pour chaque température ?
pH 7,5 7,0 6,6 6,4 6,1
Quel est le pH d’une solution aqueuse dans laquelle les ions OH- sont deux fois plus nombreux que les ions H3O+ ?
[H3O+].[OH-] = 10-14 = [H3O+].2.[H3O+] = 2.[H3O+]2 → [H3O+] = 7,07.10-8 M pH = 7,15
Quelle est la concentration en ions H3O+ d’une solution aqueuse de pH 2,7 ?
[H3O+] = 10-pH = 10-2,7 = 2,0.10-3 mol/L
Quelle est la concentration en ions OH- d’une solution aqueuse de pH 8,25 ?
pOH = 14 – 8,25 = 5,75 → [OH-] = 10-pOH = 10-5,75 = 1,78.10-6 mol/L
𝑯 𝟑 𝑶+ . 𝑶𝑯− = 𝟏𝟎−𝟏𝟒 → 𝒑𝑯 + 𝒑𝑶𝑯 = 𝟏𝟒](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-14-320.jpg)
![15
Le pH des solutions aqueuses – solutions d’acide fort
• L’acide fort réagit (quasi) totalement selon :
A(aq) + H2O(l) → B(aq) + H3O+(aq) (Ka ∞)
A l’équilibre [A] 0 mol/L et le tableau de bilan de matière s’établit facilement :
[A] [B] [H3O+] [OH-]
Avant réaction : t0 CA 0 10-7 10-7
A l’équilibre : ⇌ 0 CA 10-7 + CA 10-14/[H3O+]
• Initialement, l’eau est à l’équilibre de dissociation :
[H3O+] = [OH-] = 10-7 mol/L Kw = 10-14 mol2/L2
H2O(l) + H2O(l) ⇌ H3O+(aq) + OH-(aq)
H2O(l) V
• On ajoute nA moles de l’acide (A) dans un volume V d’eau → CA = nA/V
nA
𝑯 𝟑 𝑶+
= 𝑪 𝑨 + 𝟏𝟎−𝟕
→ 𝒑𝑯 = − 𝐥𝐨𝐠 𝑯 𝟑 𝑶+
la contribution de
l’eau est négligée !](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-15-320.jpg)
![16
Le pH des solutions aqueuses – solutions de base forte
• La base forte réagit (quasi) totalement selon :
B(aq) + H2O(l) → A(aq) + OH-(aq) (Kb ∞)
A l’équilibre [B] 0 mol/L et le tableau de bilan de matière s’établit facilement :
[A] [B] [H3O+] [OH-]
Avant réaction : t0 0 CB 10-7 10-7
A l’équilibre : ⇌ CB 0 10-14/[OH-] 10-7 + CB
• Initialement, l’eau est à l’équilibre de dissociation :
[H3O+] = [OH-] = 10-7 mol/L Kw = 10-14 mol2/L2
H2O(l) + H2O(l) ⇌ H3O+(aq) + OH-(aq)
H2O(l) V
• On ajoute nB moles de la base (B) dans un volume V d’eau → CB = nB/V
nB
𝑶𝑯−
= 𝑪 𝑩 + 𝟏𝟎−𝟕
→ 𝒑𝑶𝑯 = − 𝐥𝐨𝐠 𝑶𝑯−
→ 𝒑𝑯 = 𝟏𝟒 − 𝒑𝑶𝑯
la contribution de
l’eau est négligée !](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-16-320.jpg)
![17
Le pH des solutions aqueuses – solutions d’acide faible
[A] [B] [H3O+] [OH-]
t0 CA 0 10-7 10-7
⇌ CA - x x 10-7 + x 10-14/[H3O+]
• Initialement, l’eau est à l’équilibre de dissociation :
[H3O+] = [OH-] = 10-7 mol/L Kw = 10-14 mol2/L2
H2O(l) + H2O(l) ⇌ H3O+(aq) + OH-(aq)
H2O(l) V
• On ajoute nA moles de l’acide (A) dans un volume V d’eau → CA = nA/V
nA
𝑥 = 𝐻3 𝑂+ − 10−7 𝑒𝑡 𝐻3 𝑂+ = 𝐾 𝑎 ∙
𝐴
𝐵
= 𝐾 𝑎 ∙
𝐶𝐴 − 𝑥
𝑥
• L’acide faible réagit partiellement selon :
A(aq) + H2O(l) ⇌ B(aq) + H3O+(aq)
𝐾𝑎 =
𝐵 . 𝐻3 𝑂+
𝐴
𝐻3 𝑂+
= 𝐾 𝑎 ∙
𝐶𝐴 − 𝐻3 𝑂+ + 10−7
𝐻3 𝑂+ − 10−7
≈ 𝐾 𝑎 ∙
𝐶𝐴
𝐻3 𝑂+
𝑯 𝟑 𝑶+ = 𝑲 𝒂. 𝑪 𝑨 → 𝒑𝑯 = − 𝐥𝐨𝐠 𝑯 𝟑 𝑶+ (contribution de l’eau négligée)](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-17-320.jpg)
![18
Le pH des solutions aqueuses – solutions de base faible
[A] [B] [H3O+] [OH-]
t0 0 CB 10-7 10-7
⇌ x CB - x 10-14/[OH-] 10-7 + x
• Initialement, l’eau est à l’équilibre de dissociation :
[H3O+] = [OH-] = 10-7 mol/L Kw = 10-14 mol2/L2
H2O(l) + H2O(l) ⇌ H3O+(aq) + OH-(aq)
H2O(l) V
• On ajoute nB moles de la base (B) dans un volume V d’eau → CB = nA/V
nB
𝑥 = 𝑂𝐻− − 10−7 𝑒𝑡 𝑂𝐻− = 𝐾𝑏 ∙
𝐵
𝐴
= 𝐾𝑏 ∙
𝐶 𝐵 − 𝑥
𝑥
• La base réagit partiellement selon :
B(aq) + H2O(l) ⇌ A(aq) + OH-(aq)
𝐾𝑏 =
𝐴 . 𝑂𝐻−
𝐵
𝑂𝐻−
= 𝐾𝑏 ∙
𝐶 𝐵 − 𝑂𝐻− + 10−7
𝑂𝐻− − 10−7
≈ 𝐾𝑏 ∙
𝐶 𝐵
𝑂𝐻−
𝑶𝑯−
= 𝑲 𝒃. 𝑪 𝑩 → 𝒑𝑶𝑯 = − 𝐥𝐨𝐠 𝑶𝑯−
→ 𝒑𝑯 = 𝟏𝟒 − 𝒑𝑶𝑯
(contribution de l’eau négligée)](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-18-320.jpg)
![19
Le pH des solutions aqueuses – solutions d’acide faible + sa base faible conjuguée
• A réagit partiellement selon : A(aq) + H2O(l) → B(aq) + H3O+ (aq) (x)
• B réagit partiellement selon : B(aq) + H2O(l) → A(aq) + OH- (aq) (y)
[A] [B] [H3O+] [OH-]
t0 CA CB 10-7 10-7
⇌ CA – x + y CB + x - y 10-7 + x 10-7 + y
• Initialement, l’eau est à l’équilibre de dissociation :
[H3O+] = [OH-] = 10-7 mol/L Kw = 10-14 mol2/L2
H2O(l) + H2O(l) ⇌ H3O+(aq) + OH-(aq)
H2O(l) V
• On ajoute nA moles de A et nB moles de B dans un volume V d’eau
→ CA = nA/V et CB = nB/V
nA nB
x = [H3O+] - 10-7 et y = [OH-] - 10-7
𝐻3 𝑂+
= 𝐾 𝑎 ∙
𝐴
𝐵
= 𝐾 𝑎 ∙
𝐶𝐴 − 𝐻3 𝑂+ + 𝑂𝐻−
𝐶 𝐵 + 𝐻3 𝑂+ − 𝑂𝐻−
≈ 𝐾 𝑎 ∙
𝐶𝐴
𝐶 𝐵
𝑯 𝟑 𝑶+ = 𝑲 𝒂 ∙
𝑪 𝑨
𝑪 𝑩
𝒇𝒐𝒓𝒎𝒖𝒍𝒆 𝒅𝒆𝒔 𝒕𝒂𝒎𝒑𝒐𝒏𝒔 → 𝒑𝑯 = − 𝐥𝐨𝐠 𝑯 𝟑 𝑶+](https://image.slidesharecdn.com/acidesbasesph-170224221212/85/Acides-bases-pH-19-320.jpg)
