Le document traite de l'équilibre acido-basique, une fonction essentielle de l'organisme, en détaillant les mécanismes régulant le pH, tels que la dissociation des acides et des bases, ainsi que l'impact du CO2 et de la ventilation. Il aborde également les troubles acidobasiques, leur classification et les méthodes de diagnostic, notamment l'équation de Henderson-Hasselbalch et le modèle de Stewart. Enfin, des facteurs de variation du pH, des traitements et des exemples cliniques sont présentés pour illustrer ces concepts.

![1- Généralités
Équilibre acido-basique, ou homéostasie du PH, est une des
fonctions essentielles de l’organisme.
PH (potentiel hydrogène) d’une solution est une mesure de sa
concentration en ion H+
PH = - log [H
+]
PH = AH/A-
: déterminé par le degré de dissociation d’acide dans la
solution
- AH : Acide non dissocié
- A- : Forme dissociée en sel d’amion](https://image.slidesharecdn.com/quilibreacido-basique08-04-16-220817140316-17b20e08/85/Equilibre-Acido-Basique-ppt-2-320.jpg)
![PH = Pka + lg(HCO3
-/αPCO2)
Ka = ([H+]/A-)/[HA] : Constant de dissociation
Pka plasmatique = 6.10
α : Coefficient de solubilité de CO2
PCO2 : reflet de l’acide carbonique (H2CO3)
H+ + HCO3
- H2CO3 CO2 + H2O](https://image.slidesharecdn.com/quilibreacido-basique08-04-16-220817140316-17b20e08/85/Equilibre-Acido-Basique-ppt-3-320.jpg)






![ Chémorécepteurs centraux
H+ ne traversent pas la barrière hématoencéphalique
CO2 stimule les chémorécepteurs centraux
- Rein et PH
Rein : Excréter ( tubule proximal )ou réabsorber des ions H+
Augmenter ou diminuer le taux de réabsorption de ions HCO3
-
(Tubule proximale)
. HyperCO2 : Consevation du HCO3
- et du PH sanguin
. HypoK+ : Anse de Henle, Rein réabsorbe K+ en change de H+ :
(Acidose et hyper K+, Alcalose hypo K+). K+: 0,5mmol/L, PH : 0,1 unité
K+ attendu = 4 + [0,5 x 10 x ( 7,4 – PH mesuré )] pour Acidose
K+ attendu = 4 – [0,5 x 10 x ( PH mesuré – 7,4 )] pour Alcalose
. Hypochlorémie :
Il n’y a plus de Cl-, Rein réabsorbe HCO3
-: Alcalose hypochlorémique.
HCO3
- manque, Rein réabsorbe Cl- : Acidose hyperchlorémique
Ex. PH : 7.50, PaCO2 : 50, PaO2 : 50, Bicar : 40, K : 2.7](https://image.slidesharecdn.com/quilibreacido-basique08-04-16-220817140316-17b20e08/85/Equilibre-Acido-Basique-ppt-10-320.jpg)










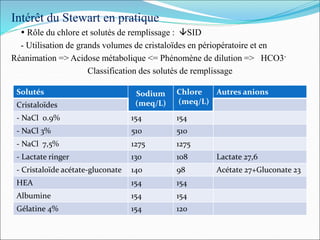













![8- Que pensez – vous de ce patient dont le coeur fibrille et
que l’on réanime depuis 5 minute ?
PH : 7,25, PaCO2 : 25, PaO2 : 212, HCO3
- : 9, K+ : 3,75, 30Kg
Pour une valeur de PH : 7,25 la kaliémie devrait :
Kaliémie attendu = 4 + [0,5 x 10 (7,40 – 7,25)] = 4,75 mmol/l
Donc la kaliémie normale pour acidose de notre patient est de 4,75mmol/l. Une
kaliémie mesurée est de 3,75 mmol/l est donc très bsasse et peut contribuer à
perpétuer la fibrillation
9- A quels problèmes vous attendez – vous chez cet opéré
cardiauqe le lendemain de l’opération ?
PH : 7,60, PaCO2 : 39, PaO2 : 89, HCO3
- : 38, K+ : 3,5, Cl- : 96, 30Kg
Hyperventilation : PaO2 : 89mmHg
Kaliémie attendu = 4 – [0,5 x 10 (7,60 – 7,40)] = 3 mmol/l
Donc la kaliémie normale pour alcalose de notre patient est de 3 mmol/l. Une
kaliémie mesurée est de 3,5 mmol/l est augmenté un petit peu (normal). Chlore bas
entretien l’alcalose en forçant les reins à retenir des bicarbonates.
PH : 7,60 démontre une alcalose. L’alcalose déprime la respiration. Pour pouvoir
sevrer ce patient du respirateur il faudra la corriger .](https://image.slidesharecdn.com/quilibreacido-basique08-04-16-220817140316-17b20e08/85/Equilibre-Acido-Basique-ppt-35-320.jpg)
