La tensiométrie
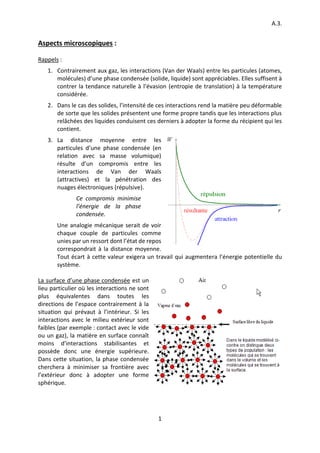
- 1. A.3. 1 Aspects microscopiques : Rappels : 1. Contrairement aux gaz, les interactions (Van der Waals) entre les particules (atomes, molécules) d’une phase condensée (solide, liquide) sont appréciables. Elles suffisent à contrer la tendance naturelle à l’évasion (entropie de translation) à la température considérée. 2. Dans le cas des solides, l’intensité de ces interactions rend la matière peu déformable de sorte que les solides présentent une forme propre tandis que les interactions plus relâchées des liquides conduisent ces derniers à adopter la forme du récipient qui les contient. 3. La distance moyenne entre les particules d’une phase condensée (en relation avec sa masse volumique) résulte d’un compromis entre les interactions de Van der Waals (attractives) et la pénétration des nuages électroniques (répulsive). Ce compromis minimise l’énergie de la phase condensée. Une analogie mécanique serait de voir chaque couple de particules comme unies par un ressort dont l’état de repos correspondrait à la distance moyenne. Tout écart à cette valeur exigera un travail qui augmentera l’énergie potentielle du système. La surface d’une phase condensée est un lieu particulier où les interactions ne sont plus équivalentes dans toutes les directions de l’espace contrairement à la situation qui prévaut à l’intérieur. Si les interactions avec le milieu extérieur sont faibles (par exemple : contact avec le vide ou un gaz), la matière en surface connaît moins d’interactions stabilisantes et possède donc une énergie supérieure. Dans cette situation, la phase condensée cherchera à minimiser sa frontière avec l’extérieur donc à adopter une forme sphérique.
- 2. A.3. 2 On peut également remarquer que les particules en surface sont globalement attirées vers l’intérieur de la phase (pas de « bretelles » de rappel vers l’extérieur du fluide) ce qui va en minimiser le nombre par effondrement vers le centre de la phase. Si on dépose avec précaution un solidesur un liquide, lasurface de ce dernier sedéforme suite à la pénétration du solide sous l’action de la force de gravitation (F = mg , E = mgh), ce qui diminue l’énergie du système (solide + liquide). En conséquence, la surface du liquide (S0 initialement) augmente obligatoirement (S1 > S0) et, pour peupler cette augmentation d’interface, des particules du liquide sont obligées de migrer depuis l’intérieur en s’opposant aux forces de rappel, ce qui augmente l’énergie du système. Une autre alternative serait d’augmenter la distance entre les particules, ce qui augmenterait également l’énergie du système. D’une manière générale, cette augmentation d’énergie reste proportionnelle à la surface créée : ∆𝐸 = 𝛾. ∆𝑆 𝑜ù 𝛾 𝑒𝑠𝑡 𝑙𝑎 𝑡𝑒𝑛𝑠𝑖𝑜𝑛 𝑠𝑢𝑝𝑒𝑟𝑓𝑖𝑐𝑖𝑒𝑙𝑙𝑒 𝑑𝑢 𝑓𝑙𝑢𝑖𝑑𝑒 Les dimensions de la tension superficielle sont celles d’une énergie/surface = masse/temps2. Cette combinaison de dimensions est rarement utilisée, on lui préfère : 1. énergie/surface = force.longueur/longueur2 = force/longueur (N/m) 2. énergie/surface = (force/longueur2).longueur = pression.longueur (P.m)
- 3. A.3. 3 Si le solide n’est pas trop dense (= exerce une pression modérée), un équilibre s’établit qui amène le solide (éventuellement plus dense que le liquide) à flotter sur le liquide. Remarque : la situation décrite ici est indépendante de la possibilité de flotter suite à la loi d’Archimède qui relève, elle, de l’hydrostatique régie par le déplacement de particules de l’intérieur du fluide. Finalement : 1. La couche superficielle d’une phase condensée se comporte comme une membrane capable d’équilibrer les pressions (modérées) appliquées au fluide. 2. Dans certaines situations, il est utile de considérer l’état d’équilibre en invoquant des forces de réaction nécessaires pour équilibrer la pesanteur. Cette description correspond à celle d’une membrane élastique réelle. 3. Dans le modèle présenté ici, aucune interaction n’est envisagée avec le milieu extérieur. C’est le cas du vide ou, en bonne approximation, celui des gaz inertes. Si, par contre, les particules du milieu extérieur sont capables d’interactions de Van der Waals (attractives), elles faciliteront la migration de celles du fluide examiné en réduisant l’énergie nécessaire pour créer une surface donnée. La notion de tension interfaciale (AB = A - B) prend cette situation en compte. 4. Pour une pression trop importante, par exemple si sa masse volumique est trop grande, le solide va pénétrer le liquide car la surface créée devient trop petite et la tension superficielle (plus exactement le produit .S) se révélera incapable d’équilibrer la chute d’énergie potentielle de gravitation (mgh). 5. Une grande tension superficielle est associée à des particules de la phase condensée en fortes interactions mutuelles (= fortes « bretelles de rappel ») de sorte que, pour une même surface créée, l’énergie mise en œuvre sera importante. On peut ainsi prévoir que, pour une même température, la tension superficielle de l’eau (avec ses liaisons hydrogène) sera très supérieure à celle de l’hexane. De même, avec la forme approximativement sphérique de ses molécules, les interactions du ter-butanol sont moins intenses que celle du n-butanol tandis que les atomes de mercure, en interaction par leurs liaisons métalliques, ne migrent que très difficilement. Substance En contact avec T (°C) (mN/m) eau air 20 72,8 n-hexane air 20 18,4 mercure vide 20 436 n-butanol vapeur 20 24,6 ter-butanol vapeur 20 20,7 Note : beaucoup d’ouvrages mentionnent encore les tensions superficielles en dyne/cm. La conversion au SI est simple puisque 1 dyne/cm = 1 mN/m.
- 4. A.3. 4 Paramètres d’influence : La masse volumique : (loi de MacLeod) La tension superficielle d’un corps pur est très sensible à son volume molaire qui reflète la distance d’équilibre entre ses particules. Le grand volume molaire des gaz témoigne d’interactions beaucoup plus faibles que celles des phases condensées. On peut ainsi s’attendre à ce que la tension superficielle varie en fonction inverse du volume molaire. Pour un liquide en équilibre avec sa phase gazeuse, de masse volumique négligeable, on observe que varie comme l’inverse de la quatrième puissance de son volume molaire : 𝛾 = ( 𝑃 𝑉𝑚 ) 4 = ( 𝑃. 𝜌 𝑀 ) 4 𝑎𝑣𝑒𝑐 𝑉𝑚 = 𝑣𝑜𝑙𝑢𝑚𝑒 𝑚𝑜𝑙𝑎𝑖𝑟𝑒 𝑑𝑢 𝑙𝑖𝑞𝑢𝑖𝑑𝑒 = 𝑀 𝜌 La constante de proportionnalité P, appelée parachor (= volume molaire lorsque = 1, ne pas confondre avec le coefficient de partage eau/octanol), est caractéristique de la substance et peut, comme la réfraction molaire, s’évaluer comme une somme de contributions. La température : (Eötvös - Ramsay - Shields) Durant ses déterminations des tensions superficielles des liquides Eötvös constate qu’il existe une relation linéaire entre et la température. Comme s’annule obligatoirement à la température critique (Tc) de toutes les substances, au-delà de laquelle il n’y a plus de différence entre le liquide et le gaz (fluide supercritique), il y fait référence dans sa relation : 𝛾 = 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒. ( 𝑇𝑐 − 𝑇) (𝛾 𝑑𝑖𝑚𝑖𝑛𝑢𝑒 𝑙𝑜𝑟𝑠𝑞𝑢𝑒 𝑇 𝑎𝑢𝑔𝑚𝑒𝑛𝑡𝑒) D’autres chercheurs (Ramsay et Shields) améliorent ensuite la relation en introduisant un décalage de 6 K. La constante ainsi définie dépend encore du liquide étudié par le biais de son volume molaire qui fait apparaître une surface Sm = (Vm)⅔ (penser aux dimensions) appelée improprement « surface molaire » (elle s’exprime en m2 mol-⅔ et pas en m2 mol-1). Dans cette nomenclature, le produit .Sm est l’énergie superficielle molaire (J mol-⅔). 𝛾. 𝑉𝑚 2 3⁄ = 𝛾. ( 𝑀 𝜌 ) 2 3⁄ = 𝑘. ( 𝑇𝑐 − 𝑇 − 6) = 𝛾 ∙ 𝑆 𝑚 La constante k = 2,1.10-7 J K-1 mol-⅔ devient commune aux liquides non associés ; elle est inférieure en cas d’association moléculaire au sein du liquide. La concentration : La tension superficielle des solutions aqueuses varie souvent régulièrement (plus ou moins linéairement) avec la concentration en solutés. Certaines classes de substances, les tensio-actifs, diminuent rapidement même pour de faibles concentrations. C
- 5. A.3. 5 Méthodes de mesure : La lame d’eau savonneuse : https://commons.wikimedia.org/wiki/File:Surface_tension_experimental_demonstration.ogv Une lame de savon est étirée par une tige mobile, avec une force F connue, selon le montage suivant. Suite à l’étirement, on augmente la surface de la lame … qui comporte deux faces ! La surface totale créée (contre la tension superficielle) vaut ainsi St = 2.S = 2.L.(x1 - x0) alors que le travail mis en jeu estdonné par ledéplacement de la force W = E= F.(x1 - x0). On obtient ainsi directement : 𝛾 = 𝑊 ∆𝑆𝑡 = 𝐹. ( 𝑥1 − 𝑥0) 2. 𝐿.( 𝑥1 − 𝑥0) = 𝐹 2. 𝐿 (𝑁 𝑚⁄ ) Remarque importante : D’après sa définition en termes énergétiques, la détermination de demande d’obtenir une énergie et une surface. La relation établie ci-dessus montre que le couple force/longueur convient également ; c’est la combinaison la plus utilisée en pratique. La méthode de Wilhelmy : Une fine plaque de masse connue (mp), généralement en platine, est chauffée au rouge (pour assurer un nettoyage parfait), refroidie, attachée au bras d’une balance, puis immergée partiellement dans le liquide à étudier. Le niveau du liquide est lentement abaissé de manière à ce que le bas de la plaque soit au niveau du liquide. A ce moment, la force exercée sur le bras de la balance comporte trois composantes : 𝐹 = 𝑃𝑜𝑖𝑑𝑠 𝑑𝑒 𝑙𝑎 𝑝𝑙𝑎𝑞𝑢𝑒 + 𝐹𝑡𝑒𝑛𝑠𝑖𝑜𝑛 𝑠𝑢𝑝𝑒𝑟𝑓𝑖𝑐𝑖𝑒𝑙𝑙𝑒 − 𝑃𝑜𝑢𝑠𝑠é𝑒 𝑑′𝐴𝑟𝑐ℎ𝑖𝑚è𝑑𝑒 1. La balance est généralement mise à zéro avec la plaque en suspension dans l’air. Cette habitude fait que la masse lue = mlue = m - mp (le premier terme disparaît). 2. Si la mesure est réalisée lorsque la base de la plaque se situe au niveau du liquide, la poussée d’Archimède (liée à l’immersion de la plaque) reste modeste. Elle sera négligée (le troisième terme disparaît). x0 x F L x1 x F L LS = L.x0 0 0 S = L.x1
- 6. A.3. 6 3. Si la plaque a été correctement nettoyée, elle sera facilement mouillée et l’angle de contact (θ) sera petit (voir plus loin). Le cos(θ) qui apparaît dans les équations sera alors proche de 1. Il reste à ce moment : 𝐹 = 𝑚 𝑙𝑢𝑒 ∙ 𝑔 = 𝛾. 𝑃é𝑟𝑖𝑚è𝑡𝑟𝑒 𝑚𝑜𝑢𝑖𝑙𝑙é = 𝛾. 2. ( 𝐿 + 𝑑) 𝑠𝑜𝑖𝑡 𝛾 = 𝑚 𝑙𝑢𝑒 ∙ 𝑔 2. ( 𝐿 + 𝑑) ( 𝑁 𝑚⁄ ) La stalagmométrie : (méthode de la goutte pendante) On forme lentement une goutte à l’extrémité d’un capillaire. Le liquide qui sort reste d’abord solidaire du capillaire malgré l’action de la pesanteur (F = m.g). Ceci résulte de la présence d’une force de tension superficielle (Fts = .longueur). Durant son évolution, la goutte grossit (sa masse et son rayon augmentent). Elle présente progressivement un étranglement qui va en s’amincissant. La goutte se détache lorsque les deux forces s’équilibrent : m.g = .longueur. La longueur à prendre en compte n’est pas clairement définie, mais la symétrie du problème suggère le périmètre d’un cercle de rayon r0 proche du rayon extérieur du capillaire. 𝑚. 𝑔 = 𝛾. 2𝜋. 𝑟0 𝑠𝑜𝑖𝑡 𝛾 = 𝑚. 𝑔 2𝜋. 𝑟0 = 𝑘. 𝑚 Devant l’incertitude sur la longueur caractéristique (r0) à prendre en compte on fait habituellement l’hypothèse qu’elle ne dépend pas de la nature du liquide ce qui permet d’envisager l’utilisation d’un liquide de référence (= de tension superficielle bien connue). Il vient alors : 𝑘 = 𝛾𝑟 𝑚 𝑟 ⇨ 𝛾 = 𝛾𝑟 ∙ ( 𝑚 𝑚 𝑟 ) Dans l’utilisationhabituelle des stalagmomètres, on compte le nombre de gouttes nécessaires pour délivrer un volume (Vt) identique pour la substance étudiée (n) et pour la référence (nr). 𝑚 = 𝜌. 𝑉 = 𝜌 ∙ 𝑉𝑡 𝑛 𝑒𝑡 𝑚 𝑟 = 𝜌𝑟 ∙ 𝑉𝑟 = 𝜌𝑟 ∙ 𝑉𝑡 𝑛 𝑟 ⇨ 𝛾 = 𝛾𝑟 ∙ 𝜌. 𝑛 𝑟 𝜌𝑟 ∙ 𝑛 La méthode de Lecomte du Nouÿ : Un anneau métallique (Pt/Ir) est plongé dans le liquide étudié puis progressivement retiré par un fil de torsion ou une microbalance qui enregistre en permanence la force nécessaire. Les diverses étapes sont illustrées ci-dessous. La force maximale (Fm) appliquée à l’anneau par le tensiomètre, observée à l’étape 7, comporte la résistance de tension superficielle et le poids de la couronne d’eau qui reste à ce moment solidaire ou influencée par l’anneau.
- 7. A.3. 7 𝐹𝑚 = 𝛾. 𝑙𝑜𝑛𝑔𝑢𝑒𝑢𝑟 + 𝑃𝑜𝑖𝑑𝑠 𝑑𝑒 𝑙𝑎 𝑐𝑜𝑢𝑟𝑜𝑛𝑛𝑒 𝑑′ 𝑒𝑎𝑢 Pour définir la longueur, on peut voir l’anneau comme une plaque de Wilhelmy courbée en cercle. Le périmètre de mouillage court sur les deux faces comme la somme des périmètres de deux cercles. Le volume du liquide (de masse volumique ) de la couronne est mal défini. On peut l’évaluer comme un tore à section rectangulaire (d.h) et de rayon R. 𝐿 𝑒𝑥𝑡 = 2𝜋 ∙ (𝑅 + 𝑑 2 ) 𝑒𝑡 𝐿𝑖𝑛𝑡 = 2𝜋 ∙ (𝑅 − 𝑑 2 ) 𝑚 𝑒𝑎𝑢 = 𝜌. 𝑉 = 𝜌. (2𝜋. 𝑅. 𝑑. ℎ) 𝐹𝑚 = 𝐿 𝑒𝑥𝑡 ∙ 𝛾 + 𝐿 𝑖𝑛𝑡 ∙ 𝛾 + 𝑚 𝑒𝑎𝑢 ∙ 𝑔 Il vient ainsi : 𝐹𝑚 = 2𝜋 ∙ (𝑅 + 𝑑 2 ) ∙ 𝛾 + 2𝜋 ∙ (𝑅 − 𝑑 2 ) ∙ 𝛾 + 𝜌. (2𝜋. 𝑅. 𝑑. ℎ). 𝑔 Le diamètre d du fil de l’anneau est généralement négligeable devant R : 𝐹𝑚 = 4𝜋 ∙ 𝑅. 𝛾 + 𝜌. (2𝜋. 𝑅. 𝑑. ℎ). 𝑔 𝑠𝑜𝑖𝑡 𝛾 = 𝐹𝑚 4𝜋. 𝑅 − 𝜌. 𝑑. ℎ. 𝑔 2 Comme cette dernière relation fournit des tensions superficielles qui ne sont pas en accord avec les valeurs issues d’autres méthodes, les tensiomètres incorporent en général un facteur de correction plus ou moins empirique (ϕ) qui est fonction de R3/Vm et R/d. 𝛾 = 𝜙 ∙ 𝐹𝑚 4𝜋. 𝑅 R h F d
- 8. A.3. 8 La capillarimétrie : L’observation de l’étalement d’une goutte sur une surface solide permet de découvrir la notion d’angle de contact (θ). Si les interactions de Van der Waals entre le liquide et le solide qui le supporte sont importantes, le liquide aura tendance à maximiser (mouiller) sa surface de contact sur le solide. Il en résulte un étalement qui diminue l’épaisseur de la goutte et l’angle de contact est faible. Avec l’affaiblissement progressif des interactions de Van der Waals, le liquide réduit sa surface de contact, il se ramasse sur lui- même pour tendre vers la forme (hémi)sphérique. L’anglede contact augmente pour culminer à 90°. Pour des interactions solide-liquide défavorables, la goutte va encore réduire sa surface de contact ce qui conduit à un angle de contact obtus. L’habitude a été prise de caractériser la qualité du contact liquide-solide par le cosinus de l’angle de contact. Pour une bonne mouillabilité (une bonne capillarité) cos(θ) ≈ 1. Pour une mouillabilité nulle (une capillarité nulle) cos(θ) = 0. Pour une mouillabilité défavorable (une capillarité défavorable) cos(θ) < 0 Le comportement d’un liquide dans un capillaire illustre parfaitement les notions de mouillabilité (capillarité). Ainsi, pour un capillaire en verre, l’eau verra son niveau monter et adoptera un ménisque concave de manière à maximiser le contact. Le mercure, par contre, fuit le contact avec le verre en adoptant une dépression et un ménisque convexe. La loi de Jurin permet de calculer la hauteur h au départ d’un bilan de forces : 𝐹𝑔 = 𝑚. 𝑔 = 𝜌. 𝑉. 𝑔 = 𝜌. 𝜋. 𝑑2 . ℎ. 𝑔 4 𝑝𝑜𝑢𝑟 𝑙𝑒 𝑝𝑜𝑖𝑑𝑠 𝑑𝑒 𝑙𝑎 𝑐𝑜𝑙𝑜𝑛𝑛𝑒 𝑑𝑒 𝑙𝑖𝑞𝑢𝑖𝑑𝑒 𝐹𝑐 = 𝑙𝑜𝑛𝑔𝑢𝑒𝑢𝑟. 𝛾. cos 𝜃 = 𝜋. 𝑑. 𝛾.cos 𝜃 𝑝𝑜𝑢𝑟 𝑙𝑎 𝑓𝑜𝑟𝑐𝑒 𝑑𝑒 𝑡𝑒𝑛𝑠𝑖𝑜𝑛 𝑠𝑢𝑝𝑒𝑟𝑓𝑖𝑐𝑖𝑒𝑙𝑙𝑒
- 9. A.3. 9 Remarque : le cosinus de l’angle de contact doit apparaître afin d’imposer l’absence de ménisque et une hauteur nulle en cas capillarité nulle (θ = /2). A l’équilibre : 𝐹𝑔 = 𝐹𝑐 ⇨ 𝜌. 𝜋. 𝑑2 . ℎ. 𝑔 4 = 𝜋. 𝑑. 𝛾. cos 𝜃 𝛾 = 𝜌. 𝑑. ℎ. 𝑔 4. cos 𝜃 (𝑙𝑜𝑖 𝑑𝑒 𝐽𝑢𝑟𝑖𝑛) Exemple : cas d’une colonne d’eau dans un capillaire en verre de diamètre 2 mm, à 20°C, = 73 mN/m, ≈ 1 g/mL, cos(θ) ≈ 1 ℎ = 4. 𝛾. cos 𝜃 𝜌. 𝑑. 𝑔 ≈ 4. 73.10−3 . 1 103. 2.10−3. 9,81 = 1,5. 10−2 𝑚 = 15 𝑚𝑚 Remarque : dans lecas d’une interaction neutre (capillariténulle, θ = /2,pas de ménisque) on a bien toujours h = 0. Interface des phases condensées : La cohésion interne : L’énergie nécessaire pour scinder un liquide en deux parties de surfaces égales (ST = 2.S) est reliée à la cohésion interne avec une expression évidente. ∆𝐸 = 𝛾 ∙ ∆𝑆 𝑇 = 𝛾. 2. ∆𝑆 = 𝑇𝐶 ∙ ∆𝑆 𝑎𝑣𝑒𝑐 𝑇𝐶 = 2. 𝛾 La tension interfaciale : ″Antonov a clarifié dès 1907 la relation entre la tension interfaciale entre deux liquides et la tension superficielle des liquides pris séparément. Il a énoncé une règle qui porte son nom et montré qu’elle était valable si les deux liquides étaient mutuellement saturés. Cette règle a eu par la suite une grande importance dans la compréhension des phénomènes de mouillage de liquides entre eux.″ On réserve généralement le terme de « tension superficielle » pour les interfaces entre un gaz (ou le vide) et une phase condensée. L’énergie nécessaire pour créer une surface commune à deux phases condensées (A et B) est alors reliée à la tension interfaciale. ∆𝐸 = 𝜎𝐴𝐵 ∙ ∆𝑆 𝑎𝑣𝑒𝑐 𝜎𝐴𝐵 = | 𝛾𝐴 − 𝛾𝐵 | (𝑟è𝑔𝑙𝑒 𝑑′ 𝐴𝑛𝑡𝑜𝑛𝑜𝑓𝑓) Si les deux phases sont partiellement miscibles, chaque phase va modifier la tension superficielle de l’autre. On écrit alors : ∆𝐸 = 𝜎𝐴𝐵 ∙ ∆𝑆 𝑎𝑣𝑒𝑐 𝜎𝐴𝐵 = | 𝛾𝐴 ′ − 𝛾𝐵 ′ | La tension d’adhésion : L’énergie nécessaire pour séparer deux liquides en deux parties de surfaces égales est reliée à la tension d’adhésion. ∆𝐸 = 𝑇𝐴/𝐵 ∙ ∆𝑆 𝑎𝑣𝑒𝑐 𝑇𝐴/𝐵 = 𝛾𝐴 + 𝛾𝐵 − 𝜎𝐴𝐵 A B A B A B B A AB
