Le document traite de l'équilibre acido-basique, essentiel pour le bon fonctionnement de l'organisme, en décrivant les variations de pH sanguin, les mécanismes de régulation par les systèmes tampons, la respiration et les reins. Il aborde également les troubles comme l'acidose et l'alcalose, leurs causes, effets et traitements possibles. La régulation du pH est critique car des valeurs extrêmes peuvent être incompatibles avec la vie.


![Introduction
L’équilibre acido-basique, ou homéostasie du pH, est
une des fonctions essentielles de l’organisme.
Le pH (potentiel hydrogène) d’une solution est une
mesure de sa concentration en ions H+. pH = - log [H+].
La [H+] dans l’organisme est très faible (concentration
dans le plasma artériel = 0,00004 mEq/L soit 40
nmol/L), par rapport à d’autres ions (Na+≈135 mEq/L).](https://image.slidesharecdn.com/eab-med-pharma-2011-ppt-130310070913-phpapp01/85/Eab-med-pharma-2011-ppt-3-320.jpg)
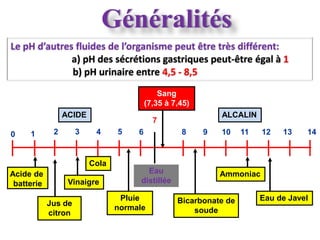
![ Chez l’homme, la constance du pH concerne non
seulement le sang, mais également les autres humeurs
et le contenu cellulaire. Cependant, le sang par son
accessibilité immédiate, reste le meilleur reflet du pH
du milieu intérieur.
Le pH sanguin varie de 7,36 à 7,42.
Le maintien strict d’un pH normal est essentiel car les
fonctions enzymatiques de l’organisme sont très
sensibles aux variations de [H+].
Des pH < 7 et > 7,8 sont incompatibles avec la vie.](https://image.slidesharecdn.com/eab-med-pharma-2011-ppt-130310070913-phpapp01/85/Eab-med-pharma-2011-ppt-4-320.jpg)






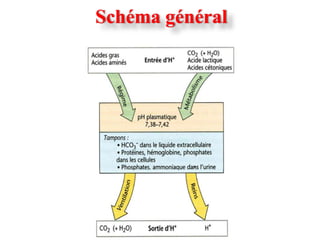
![EQUILIBRE ACIDE-BASE
3 Systèmes ou mécanismes physiologiques de maintien du pH.
1. Les systèmes tampons
2. La régularisation pulmonaire de la [CO2 ]
ou ventilation
3. La régulation rénale
• élimine les acides (et bases) en excès;
• régénère les bicarbonates](https://image.slidesharecdn.com/eab-med-pharma-2011-ppt-130310070913-phpapp01/85/Eab-med-pharma-2011-ppt-12-320.jpg)








![Tampons extracellulaires : H2CO3 / HCO3-
La concentration d’ions bicarbonates est d’environ 24 mEq/L dans le plasma
alors que la concentration d’ions H+ est seulement de 0,00004 mEq/L. C’est la
fixation des ions H+ par l’hémoglobine qui explique cette différence.
Les HCO3 - plasmatiques sont ainsi disponibles pour tamponner les excès d’ions
H+ d’origine métabolique.
La réaction : CO2 + H2O H2CO3 H+ + HCO3- régit le fonctionnement
de ce système tampon.
Le pH est déterminé par l'équation d'Henderson-Hasselbach :
HCO3-
pH = 6,1 + log
0,03. pCO2
• pKa (HCO3- / H2CO3) = 6,1 HCO3- : facteur rénal ou métabolique
• [H2CO3] = 0,03 x pCO2
• α = 0,03 : coefficient de solubilité du CO2 pCO2 : facteur ventilatoire ou pulmonaire
• pCO2 = 40 mmHg ou 5,3 KPa](https://image.slidesharecdn.com/eab-med-pharma-2011-ppt-130310070913-phpapp01/85/Eab-med-pharma-2011-ppt-22-320.jpg)
![Sachant que les concentrations de CO2 et de HCO3- sont dans un rapport de 1/20
et considérant une concentration en HCO3- chez l’Homme de 24 mmol/l et
[CO2]= 1,2 mmol/l, le pH sanguin calculé sera égal :
6,1 + log 20 = 7,40
Le tampon bicarbonate présente l’avantage de pouvoir
fonctionner en système ouvert !
Supposons maintenant un apport de 2 mmoles/l de H+:
En système fermé:
la concentration de HCO3- devient donc 24-2 = 22 mM
et la concentration en CO2 sera égale à 1,2+2 = 3,2
mM, d'où le pH:
En système ouvert, et en ne considérant que
l'élimination du CO2 en excès par voie
respiratoire, nous obtenons:](https://image.slidesharecdn.com/eab-med-pharma-2011-ppt-130310070913-phpapp01/85/Eab-med-pharma-2011-ppt-23-320.jpg)


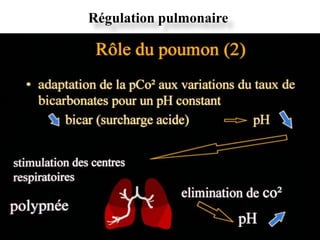
![La ventilation va pouvoir ajuster le pH par l’intermédiaire de deux
stimuli: H+ et pCO2
Chémorécepteurs aortiques et carotidiens
• Stimulés par l’augmentation de [H+] plasmatique.
• Stimulation des centres respiratoires bulbaires.
• Augmentation de la ventilation, élimination de plus de CO2 et
transformation des ions H+en H2CO3.
Chémorécepteurs centraux
• H+ne traversent pas la barrière hémato-encéphalique. Mais
les changements de pH modifient la pCO2 et le CO2 stimule
les chémorécepteurs centraux.
Cette stimulation chémosensible va permettre de répondre à toute
modification du pH et du CO2 plasmatique](https://image.slidesharecdn.com/eab-med-pharma-2011-ppt-130310070913-phpapp01/85/Eab-med-pharma-2011-ppt-27-320.jpg)


















