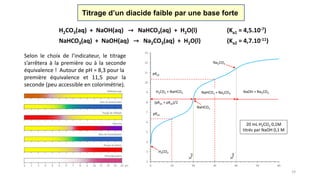
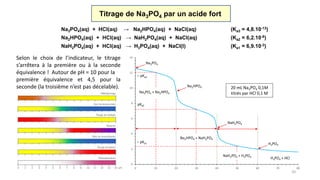
Le document traite des principes de titrage volumétrique et des réactions acido-basiques, détaillant les méthodes pour déterminer la concentration de solutions inconnues à l'aide d'additions progressives de réactifs. Il explique les calculs associés aux équations stoechiométriques et aux constantes d'équilibre pour différentes réactions, tout en illustrant des exemples pratiques d'analyse. Le texte aborde également des cas spécifiques de titrage, y compris les titrages entre acides et bases forts.


![3
Les réactions acido-basiques
Deux couples acide/base (autres que l’eau) sont mis en jeu.
L’objectif est de déterminer la constante d’équilibre (Kc) de ces réactions.
Ka1 = [Base1].[H3O+]/[Acide1]
Ka2 = [Base2].[H3O+]/[Acide2]Acide1(aq) + Base2(aq) ⇌ Base1(aq) + Acide2(aq)
H+ H+
𝐾𝑐 =
𝐵𝑎𝑠𝑒1 . 𝐴𝑐𝑖𝑑𝑒2
𝐴𝑐𝑖𝑑𝑒1 . 𝐵𝑎𝑠𝑒2
=
𝐵𝑎𝑠𝑒1 . 𝐴𝑐𝑖𝑑𝑒2
𝐴𝑐𝑖𝑑𝑒1 . 𝐵𝑎𝑠𝑒2
∙
𝐻3 𝑂+
𝐻3 𝑂+
=
𝐾 𝑎1
𝐾 𝑎2
Les constantes d’acidité permettent de calculer les constantes
d’équilibre des réactions acido-basiques. Attention de ne pas
confondre le numérateur et le dénominateur !](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-3-320.jpg)


![Les titrages acido-basiques
500 mg de carbonate de calcium contaminés par une impureté inerte sont mis en suspension dans 100 mL d’eau. Un
titrage lent de cette suspension par HCl 0,2 M se termine pour Véq = 45 mL. Quelle est la pureté de ce carbonate ?
(1) Equation du titrage : CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
(2) n(HCl, ajouté)/2 = n(CaCO3, prise) = 0,2.0,045/2 = 0,0045 mol
(3) soit m = n.M = 0,0045.(40 + 12 + 4.16) = 0,450 g de carbonate de calcium
→ pureté = 100.m(trouvée)/(masse de la prise) = 100.0,450/0,500 = 90 %.
Une des eaux minérales les plus chargées en minéraux indique une teneur
(moyenne) en ions bicarbonates de 4368 mg/L. Pour vérifier cette affirmation
il a été décidé d’effectuer un titrage par HNO3 0,5 M sur une prise de 250 mL.
Calculer le volume Véq si la composition annoncée est correcte.
(1) HCO3-(aq) + HNO3(aq) → NO3-(aq) + CO2(g) + H2O(l)
(2) n(HNO3, ajouté) = n(HCO3
-, prise) = m(HCO3
-, prise)/M(HCO3
-) = C(HNO3).V(HNO3)
(3) V(HNO3) = (4,368/4)/[(1 + 12 + 3.16).0,5] = 0,0358 L = 35,8 mL.
Une même prise d’eau minérale est portée à l’ébullition, avant titrage avec la même solution d’acide nitrique, afin
de décomposer tous les ions bicarbonates en ions carbonates. Calculer le volume Véq dans ces conditions.
6](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-6-320.jpg)
![7
Titrage d’un acide fort par une base forte
Initialement, on a une solution
0,05 M en acide fort (HCl).
[H3O+] = CHCl + 10-7 0,05 M
pH = - log(0,05) = 1,30
A l’équivalence, on a une solution de NaCl
dans l’eau (plus ‘acide et pas d’excès de
base). Les deux ions, Na+(aq) et Cl-(aq)
formés par dissociation sont spectateurs.
pH = 7,00
Avant l’équivalence, on a une solution
résiduelle d’acide fort (CHCl < 0,05 M) et
de chlorure de sodium (spectateur).
[H3O+] = CHCl + 10-7 < 0,05 M
pH = > 1,30
Après l’équivalence, on a une solution
de base forte (CNaOH < 0,1 M) et d’un
sel spectateur (NaCl).
[OH-] = CNaOH + 10-7 > 10-7
pOH < 7
pH = 14 - pOH > 7,00
Initialement, CHCl = 0,05 M
solution de NaOH
de concentration
CNaOH = 0,1 M
VNaOH (ajouté)
V = 0,100 + VNaOH
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) (réaction complète)
CA.VA = CB.VB → Véq = CHCl.VHCl/CNaOH = 0,05.0,100/0,1 = 0,050 L = 50 mL](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-7-320.jpg)
![8
Calculer le pH après l’addition de 20 mL de NaOH (avant l’équivalence).
n(NaOH, ajouté) = 0,1.0,020 = 0,002 mol
n(HCl, résiduel) = n°(HCl) - n(NaOH, ajouté) = 0,05.0,1 - 0,002 = 0,003 mol
n(NaOH, résiduel) = 0,002 – 0,002 = 0 mol (réaction complète)
Volume total = 0,100 + 0,020 = 0,120 L → CHCl = 0,003/0,120 = 0,025 M
[H3O+] = CHCl + 10-7 0,025 M → pH = - log(0,025) = 1,60
Calculer le pH après l’addition de 60 mL de NaOH (après l’équivalence).
n(NaOH, ajouté) = 0,1.0,060 = 0,006 mol
n(HCl, résiduel) = 0 mol (on est après l’équivalence)
n(NaOH, résiduel) = 0,006 – n°(HCl) = 0,006 – 0,05.0,1 = 0,001 mol
Volume total = 0,100 + 0,060 = 0,160 L → CNaOH = 0,001/0,160 = 0,00625 M
[OH-] = CNaOH + 10-7 0,00625 M → pOH = - log(0,00625) = 2,20
→ pH = 14 - pOH = 11,80
Initialement, CHCl = 0,05 M
solution de NaOH
de concentration
CNaOH = 0,1 M
VNaOH (ajouté)
V = 0,100 + VNaOH
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) (réaction complète)
CA.VA = CB.VB → Véq = CHCl.VHCl/CNaOH = 0,05.0,100/0,1 = 0,050 L = 50 mL
Titrage d’un acide fort par une base forte](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-8-320.jpg)
![9
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) (réaction complète)
CA.VA = CB.VB → Véq = CHCl.VHCl/CNaOH = 0,05.0,100/0,1 = 0,050 L = 50 mL
Titrage d’un acide fort par une base forte
On prévoit facilement que le pH = 7
à l’équivalence, il faut donc adopter
un indicateur qui vire (= change de
couleur) vers pH = 7.
0
1
2
3
4
5
6
7
8
9
10
11
12
13
0 10 20 30 40 50 60 70 80
[H3O+] = CHCl + 10-7
[OH-] = CNaOH + 10-7
HCl + NaCl NaOH + NaCl
NaCl
HCl](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-9-320.jpg)
![10
Initialement, on a une solution
0,05 M en base forte (NaOH).
[OH-] = CNaOH + 10-7 0,05 M
pOH = - log(0,05) = 1,30
pH = 14 – pOH = 12,70
A l’équivalence, on a une solution de NaCl
dans l’eau (plus de base et pas d’excès
d’acide). Les deux ions, Na+(aq) et Cl-(aq)
formés par dissociation sont spectateurs.
pH = 7,00
Avant l’équivalence, on a une solution
résiduelle de base forte (CNaOH < 0,05 M)
et de chlorure de sodium (spectateur).
[OH-] = CNaOH + 10-7 < 0,05 M
pOH = - log [OH-] > 1,30
pH = 14 – pOH < 12,70
Après l’équivalence, on a une solution
d’acide fort (CHCl < 0,1 M) et d’un sel
spectateur (NaCl).
[H3O+] = CHCl + 10-7 > 10-7
pH = - log [H3O+] < 7,00
Initialement, CNaOH = 0,05 M
solution de HCl
de concentration
CHCl = 0,1 M
VHCl (ajouté)
V = 0,100 + VHCl
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) (réaction complète)
CA.VA = CB.VB → Véq = CNaOH.VNaOH/CHCl = 0,05.0,100/0,1 = 0,050 L = 50 mL
Titrage d’une base forte par un acide fort](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-10-320.jpg)
![11
Titrage d’une base forte par un acide fort
Calculer le pH après l’addition de 30 mL de NaOH (avant l’équivalence).
n(HCl, ajouté) = 0,1.0,030 = 0,003 mol
n(NaOH, résiduel) = n°(NaOH) - n(HCl, ajouté) = 0,05.0,1 - 0,003 = 0,002 mol
n(HCl, résiduel) = 0,003 – 0,003 = 0 mol (réaction complète)
Volume total = 0,100 + 0,030 = 0,130 L → CNaOH = 0,002/0,130 = 0,0154 M
[OH-] = CNaOH + 10-7 0,0154 M → pH = - log(0,0154) = 1,81
→ pH = 14 - 1,81 = 12,19
Calculer le pH après l’addition de 57 mL de HCl (après l’équivalence).
n(HCl, ajouté) = 0,1.0,057 = 0,0057 mol
n(NaOH, résiduel) = 0 mol (on est après l’équivalence)
n(HCl, résiduel) = 0,0057 – n°(NaOH) = 0,0057 – 0,05.0,1 = 0,0007 mol
Volume total = 0,100 + 0,057 = 0,157 L → CHCl = 0,0007/0,157 = 0,00446 M
[H3O+] = CHCl + 10-7 0,00446 M → pH = - log(0,00446) = 2,35
Initialement, CNaOH = 0,05 M
solution de HCl
de concentration
CHCl = 0,1 M
VHCl (ajouté)
V = 0,100 + VHCl
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) (réaction complète)
CA.VA = CB.VB → Véq = CNaOH.VNaOH/CHCl = 0,05.0,100/0,1 = 0,050 L = 50 mL](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-11-320.jpg)
![12
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) (réaction complète)
CA.VA = CB.VB → Véq = CNaOH.VNaOH/CHCl = 0,05.0,100/0,1 = 0,050 L = 50 mL
On prévoit facilement que le pH = 7
à l’équivalence, il faut donc adopter
un indicateur qui vire (= change de
couleur) vers pH = 7.
Titrage d’une base forte par un acide fort
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
0 10 20 30 40 50 60 70
NaOH + NaCl HCl + NaCl
[OH-] = CNaOH + 10-7
[H3O+] = CHCl + 10-7
NaCl
NaOH](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-12-320.jpg)
![13
Titrage d’un acide faible par une base forte
Initialement, on a une solution
0,05 M en acide faible (HF).
[H3O+] = (Ka.CHF)½ = 0,00561 M
pH = - log(0,00561) = 2,25
A l’équivalence, on a une solution de NaF dans
l’eau (plus d’acide et pas d’excès de base). Les
ions Na+(aq) sont spectateurs et F-(aq) basiques.
pH > 7,00
Avant l’équivalence, on a une solution
d’acide faible (HF) et de sa base faible
conjuguée (F-) avec Na+ spectateur.
[H3O+] = Ka.CHF/CNaF
pH > 2,25 (tampon)
Après l’équivalence, on a une solution
de base forte (CNaOH < 0,1 M) et d’une
base faible (F-) qui est négligée.
[OH-] = CNaOH + 10-7 > 10-7
pOH < 7
pH = 14 - pOH > 7,00
Initialement, CHF = 0,05 M
solution de NaOH
de concentration
CNaOH = 0,1 M
VNaOH (ajouté)
V = 0,100 + VNaOH
HF(aq) + NaOH(aq) → NaF(aq) + H2O(l) (Ka = 6,31.10-4)
CA.VA = CB.VB → Véq = CHF.VHF/CNaOH = 0,05.0,100/0,1 = 0,050 L = 50 mL](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-13-320.jpg)
![14
Calculer le pH après l’addition de 25 mL de NaOH (avant l’équivalence).
n(NaOH, ajouté) = 0,1.0,025 = 0,0025 mol
n(HF, résiduel) = n°(HF) - n(NaOH, ajouté) = 0,05.0,1 - 0,0025 = 0,0025 mol
n(NaOH, résiduel) = 0,0025 – 0,0025 = 0 mol (réaction complète)
n(NaF, formé) = 0 + 0,0025 mol Volume total = 0,100 + 0,025 = 0,125 L
→ CHF = 0,0025/0,125 = 0,020 M CNaF = 0,0025/0,125 = 0,020 M (demi-titrage)
[H3O+] = Ka.CHF/CNaF = 6,31.10-4.0,025/0,025 M → pH = - log(6,31.10-4) = 3,20.
Calculer le pH après l’addition de 60 mL de NaOH (après l’équivalence).
n(NaOH, ajouté) = 0,1.0,060 = 0,006 mol
n(HF, résiduel) = 0 mol (on est après l’équivalence)
n(NaF, formé) = n°(HF) = 0,005 mol
n(NaOH, résiduel) = 0,006 – n°(HF) = 0,006 – 0,05.0,1 = 0,001 mol
Volume total = 0,100 + 0,060 = 0,160 L → CNaOH = 0,001/0,160 = 0,00625 M
[OH-] = CNaOH + 10-7 0,00625 M → pOH = - log(0,00625) = 2,20
→ pH = 14 - pOH = 11,80 (la basicité de F-, une base faible, est négligée).Initialement, CHF = 0,05 M
solution de NaOH
de concentration
CNaOH = 0,1 M
VNaOH (ajouté)
V = 0,100 + VNaOH
HF(aq) + NaOH(aq) → NaF(aq) + H2O(l) (Ka = 6,31.10-4)
CA.VA = CB.VB → Véq = CHF.VHF/CNaOH = 0,05.0,100/0,1 = 0,050 L = 50 mL
Titrage d’un acide faible par une base forte](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-14-320.jpg)
![15
Titrage d’un acide faible par une base forte
HF(aq) + NaOH(aq) → NaF(aq) + H2O(l) (Ka = 6,31.10-4)
CA.VA = CB.VB → Véq = CHF.VHF/CNaOH = 0,05.0,100/0,1 = 0,050 L = 50 mL
On prévoit facilement que le pH > 7
à l’équivalence. Ici, il faut adopter
un indicateur qui vire (= change de
couleur) vers pH = 7,9.
0
1
2
3
4
5
6
7
8
9
10
11
12
13
0 10 20 30 40 50 60 70 80
HF + NaF NaOH + NaF
[OH-] = CNaOH + 10-7[H3O+] = Ka.CHF/CNaF
NaF
HF
A l’équivalence, on a une solution de base
faible (F-) de concentration 0,05.0,1/0,15
= 0,0333 M → pH = 7,86.
pKa
Veq/2](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-15-320.jpg)
![16
Titrage d’une base faible par un acide fort
Initialement, on a une solution
0,05 M en base faible (NH3).
[OH-] = (Kb.CNH3)½ = 9,37.10-4 M
pOH = - log(9,37.10-4) = 3,03
pH = 14 - 3,03 = 10,97
A l’équivalence, on a une solution de
NH4Cl dans l’eau (plus de base et pas
d’excès d’acide). Les ions Na+(aq) sont
spectateur et les NH4
+(aq) formés par
dissociation sont acides.
pH < 7,00
Avant l’équivalence, on a une solution
résiduelle de base faible (CNH3 < 0,05 M)
et de chlorure d’ammonium (tampon).
[H3O+] = Ka.CNH4Cl/CNH3
pH = < 10,97
Après l’équivalence, on a une solution
d’acide fort (CHCl < 0,1 M) et de
chlorure d’ammonium (acide faible).
[H3O+] = CHCl + 10-7 > 10-7
pH = - log [H3O+] < 7,00
Initialement, CNH3 = 0,05 M
solution de HCl
de concentration
CHCl = 0,1 M
VHCl (ajouté)
V = 0,100 + VHCl
HCl(aq) + NH3(aq) → NH4Cl(aq) (Ka = 5,7.10-10)
CA.VA = CB.VB → Véq = CNH3.VNH3/CHCl = 0,05.0,100/0,1 = 0,050 L = 50 mL](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-16-320.jpg)
![17
Titrage d’une base faible par un acide fort
Calculer le pH après l’addition de 15 mL de NaOH (avant l’équivalence).
n(HCl, ajouté) = 0,1.0,015 = 0,0015 mol
n(NH3, résiduel) = n°(NH3) - n(HCl, ajouté) = 0,05.0,1 - 0,0015 = 0,0035 mol
n(NH4Cl, formé) = n(HCl, ajouté = 0,0015 mol
n(HCl, résiduel) = 0,0015 – 0,0015 = 0 mol (réaction complète)
Volume total = 0,100 + 0,015 = 0,115 L → CNH3 = 0,0035/0,115 = 0,0304 M
CNH4Cl = 0,0015/0,115 = 0,0130 M → [H3O+] = 5,7.10-10.0,0130/0,0304 → pH = 9,61
Calculer le pH après l’addition de 55 mL de HCl (après l’équivalence).
n(HCl, ajouté) = 0,1.0,055 = 0,0055 mol
n(NH3, résiduel) = 0 mol (on est après l’équivalence)
n(HCl, résiduel) = 0,0055 – n°(NH3) = 0,0055 – 0,05.0,1 = 0,0005 mol
Volume total = 0,100 + 0,055 = 0,155 L → CHCl = 0,0005/0,155 = 0,00322 M
[H3O+] = CHCl + 10-7 0,00322 M → pH = - log(0,00322) = 2,49
L’acidité de NH4
+(aq) est négligée devant celle de HCl.
Initialement, CNH3 = 0,05 M
solution de HCl
de concentration
CHCl = 0,1 M
VHCl (ajouté)
V = 0,100 + VHCl
HCl(aq) + NH3(aq) → NH4Cl(aq) (Ka = 5,7.10-10)
CA.VA = CB.VB → Véq = CNH3.VNH3/CHCl = 0,05.0,100/0,1 = 0,050 L = 50 mL](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-17-320.jpg)
![18
HCl(aq) + NH3(aq) → NH4Cl(aq) (Ka = 5,7.10-10)
CA.VA = CB.VB → Véq = CNH3.VNH3/CHCl = 0,05.0,100/0,1 = 0,050 L = 50 mL
On prévoit facilement que le pH < 7
à l’équivalence. Ici, il faut donc adopter
un indicateur qui vire (= change de
couleur) vers pH = 5,5.
Titrage d’une base faible par un acide fort
0
1
2
3
4
5
6
7
8
9
10
11
12
0 10 20 30 40 50 60 70 80
HCl + NH4Cl
[H3O+] = CHCl + 10-7
NH4Cl
NH3
pKa
Veq/2
[H3O+] = Ka.CNH4Cl/CNH3
NH3 + NH4Cl](https://image.slidesharecdn.com/lestitragesacido-basiques-170224221439/85/Les-titrages-acido-basiques-18-320.jpg)