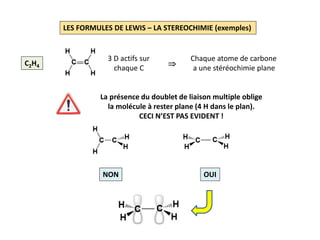
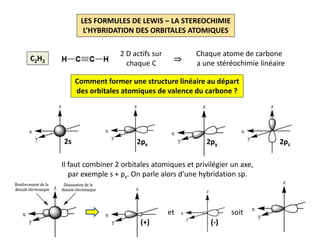
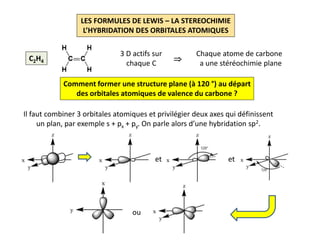
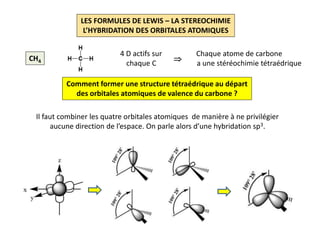
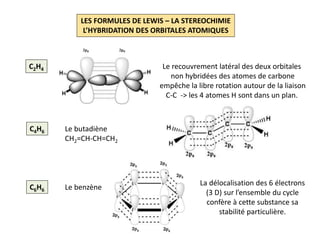
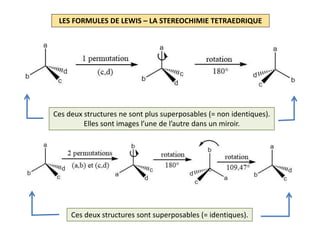
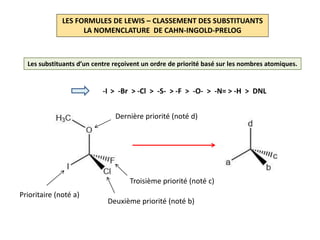
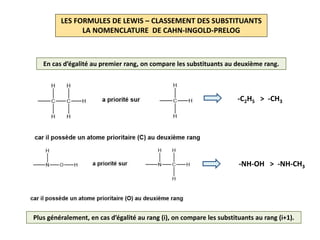
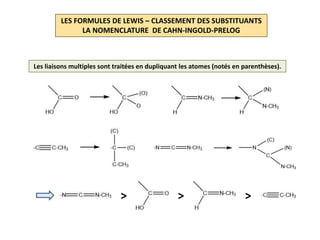
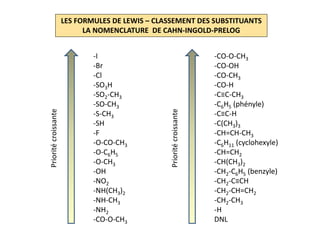
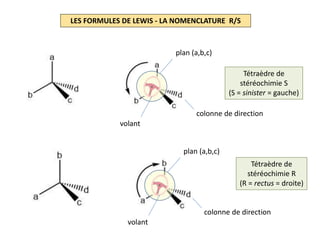
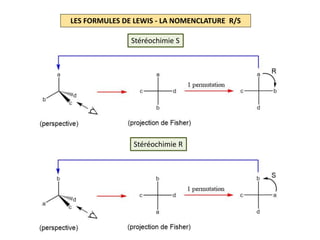
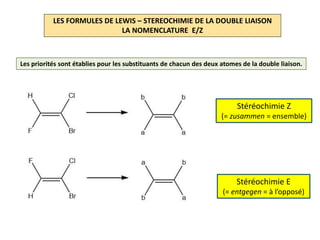
Le document explique la formation et l'utilisation des formules de Lewis, incluant des règles pour compter les électrons de valence et établir des structures moléculaires. Il aborde aussi la mésomérie, les charges formelles, et les nombres d'oxydation, ainsi que des méthodes liées à la stéréochimie et à l'hybridation des orbitales. Enfin, il détaille la nomenclature Cahn-Ingold-Prelog pour classer les substituants et la stéréochimie des doubles liaisons.

![LES FORMULES DE LEWIS – EXEMPLES (1)
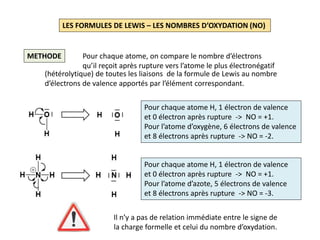
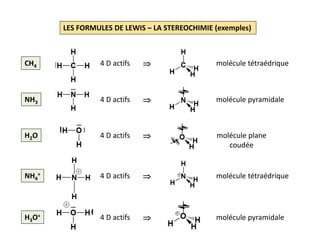
H2 H: 1s1 2 EV soit 1 D
Squelette: avec 1 DL et 2 électrons
autour de chaque atome
Formule de Lewis:
CH4 H: 1s1 ; C: [He] 2s2 2p2 8 EV soit 4 D
Squelette: avec 4 DL , 2 électrons
autour de chaque atome
d’hydrogène et 8 électrons
autour de l’atome de carbone
Formule de Lewis:](https://image.slidesharecdn.com/lesformulesdelewis-151103112515-lva1-app6891/85/Les-formules-de-Lewis-2-320.jpg)
![LES FORMULES DE LEWIS – EXEMPLES (2)
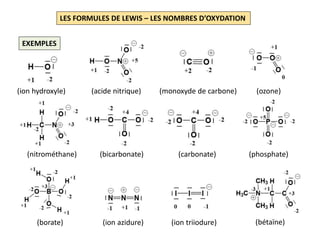
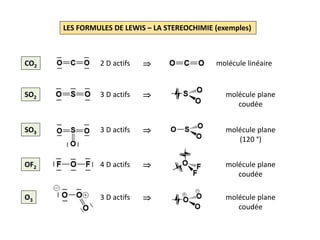
NH3 H: 1s1 ; N: [He] 2s2 2p3 8 EV soit 4 D
Squelette: avec 3 DL , 2 électrons
autour de chaque atome
d’hydrogène et 6 électrons
autour de l’atome d’azote
Formule de Lewis: il reste à distribuer un doublet
qui sera attribué à l’azote car les
les atomes d’hydrogène
appartiennent à la 1e période
H2O H: 1s1 ; O: [He] 2s2 2p4 8 EV soit 4 D
Squelette: avec 2 DL , 2 électrons
autour de chaque atome
d’hydrogène et 4 électrons
autour de l’atome d’oxygène
Formule de Lewis: il reste à distribuer 2 doublets
qui seront attribués à l’oxygène
car les atomes d’hydrogène
appartiennent à la 1e période](https://image.slidesharecdn.com/lesformulesdelewis-151103112515-lva1-app6891/85/Les-formules-de-Lewis-3-320.jpg)
![LES FORMULES DE LEWIS – EXEMPLES (3)
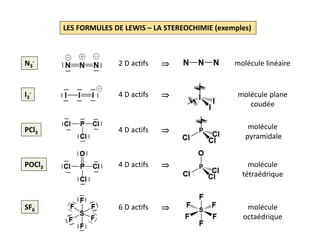
CO2 C: [He] 2s2 2p2 ; O: [He] 2s2 2p4 16 EV soit 8 D
Squelette: avec 2 DL , 2 électrons autour de
chaque atome d’oxygène et 4
électrons autour du carbone
Formule de Lewis: il reste à distribuer 6 doublets ;
2 DL vers le carbone (maximum
atteint) et 2 DNL à chaque oxygène
SO2 O: [He] 2s2 2p4 ; S: [Ne] 3s2 3p4 18 EV soit 9 D
Squelette: avec 2 DL , 2 électrons autour de
chaque atome d’oxygène et 4
électrons autour du soufre
Formule de Lewis: il reste à distribuer 7 doublets ;
2 DL, 2 DNL sur chaque oxygène
(maximum atteint, cf. CO2) et
1 DNL sur l’atome de soufre](https://image.slidesharecdn.com/lesformulesdelewis-151103112515-lva1-app6891/85/Les-formules-de-Lewis-4-320.jpg)
![LES FORMULES DE LEWIS – EXEMPLES (4)
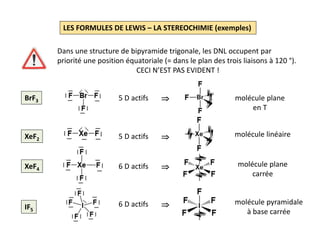
SF6 F: [He] 2s2 2p5 ; S: [Ne] 3s2 3p4 48 EV soit 24 D
Squelette: 6 DL pour le squelette ;
l’atome de soufre doit
s’accomoder de 12 électrons
autour de lui (3e période)
Formule de Lewis: reste 18 D à répartir ;
chaque atome de fluor
reçoit 3 DNL et est ainsi
entouré de 8 électrons
H2CO3
H: 1s1 ; C: [He] 2s2 2p2 ; O: [He] 2s2 2p4
24 EV soit 12 D
Squelette: 5 DL pour le squelette ;
1 DL entre C et O puis
2 DNL sur chaque O
Formule de Lewis:](https://image.slidesharecdn.com/lesformulesdelewis-151103112515-lva1-app6891/85/Les-formules-de-Lewis-5-320.jpg)