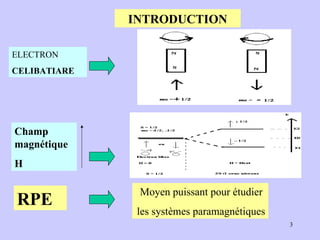
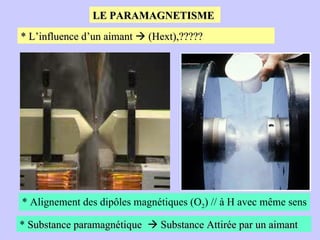
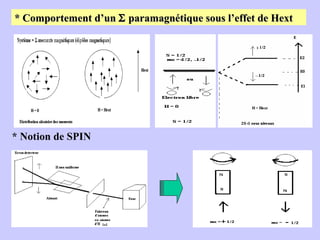
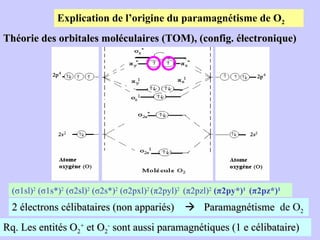
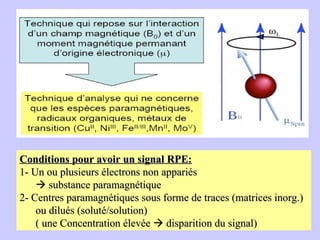
Le document traite de la spectrométrie de résonance paramagnétique électronique (RPE), une technique développée pour étudier les systèmes paramagnétiques, en particulier les ions de transition. Il aborde les concepts fondamentaux du paramagnétisme, l'effet Zeeman, et les applications de la RPE dans les domaines agroalimentaires, pharmaceutiques et biomédicaux. La RPE est présentée comme une méthode non destructive et quantitative, capable de fournir des informations sur les radicaux libres et les moments magnétiques des spins électroniques.





![Comparaison des complexes [Fe(CN) 6 ] 4- et [Mn(H 2 O) 6 ] 2+ Le complexe hexacyanoferrat(II) est diamagnétique, car il contient le cation Fe 2+ ( système d 6 ) et six ligands anioniques CN - ( ligands à 2 électrons ) avec tous les électrons appariés en doublets (hybridation d 2 sp 3 ). Le complexe hexaaquamanganèse(II) est paramagnétique, le cation Mn 2+ ( système d 5 ) et six ligands neutres H 2 O ( ligands à 2 électrons ) avec 5 électrons non appariés (hybridation sp 3 d 2 ). Un cristal de sel K 4 [Fe(CN) 6 ] est alors repoussé par un champs magnétique non uniforme, mais l'effet diamagnétique est très faible et ne peut être démontré qu'avec un appareillage très fin. Un cristal du sel [Mn(H 2 O) 6 ]SO 4 est alors attiré par un champs magnétique non uniforme, l'effet paramagnétique est fort et peut être démontré avec un système expérimental simple. Magétisme moléculaire](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-8-320.jpg)



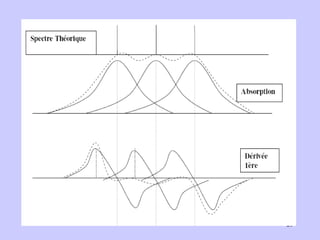
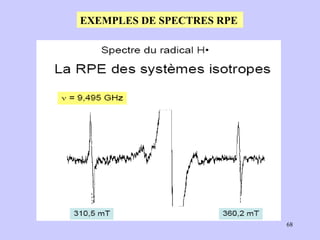
![Un spectre RPE est caractérisé par : 1-Sa forme (L ou G) 2- Sa position (g, H0) 3- Sa largeur ΔHpp 4- Son amplitude App Schéma de spectre RPE/ amplitude App et largeur du spectre ΔHpp [Poole, 1983]](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-19-320.jpg)




![Cas de l’atome d’Hydrogène (ou Hydrogenoîde : Ze+, 1e ) HΨ = EΨ H = -ħ 2 /2m . Δ + V – Ze 2 /r = V , Δ = opérateur Laplatien = d 2 /dx 2 + d 2 /dy 2 +d 2 /dz 2 ) Ψ = Ψ n, l, ml = Rn, l (r) . Yl, ml (θ, φ) -ħ 2 /2m . Δ Ψ –Ze 2 /r Ψ – EΨ = 0 (Ei ? pour les quelles det = 0) En = -[( Z 2 . e 4 . m 2 )/ 2 ħ ]. [1/n 2 ]](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-27-320.jpg)
![On a pu mettre en évidence les séries spectrales suivantes (déjà trouvées par BOHR) : Dans l’UV Série de Lyman ν = R (1/1 2 – 1/n 2 ), n= 2, 3, 4, … Dans le visible Série de Balmer ν = R (1/2 2 – 1/n 2 ), n= 3, 4, 5,… Dans l’ IR Série de Pashen ν = R (1/3 2 – 1/n 2 ), n= 4, 5, 6,… Dans l’ IR Série de Brackett ν = R (1/4 2 – 1/n 2 ), n= 5, 6, 7,…. Valeurs propres : En = -[( Z 2 . e 4 . m 2 )/ 2 ħ ]. [1/n 2 ] En dépend uniquement de n. ΔE = Em-En = hν ; ν = R (1/m 2 – 1/n 2 ) : Formule de Balmer * Niveaux d’énergie dans l’atome d’hydrogène avec des séries d’émissions * Chaque niveau d ‘énergie est associée à un mouvement de l’électron sur son orbite](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-28-320.jpg)








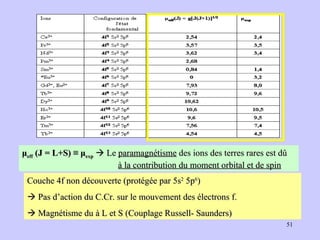
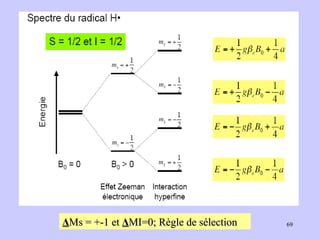
![g J = 1 + [J(J+1) + S(S+1) – L(L+1)]/2J(J+1) L : moment orbital S : moment de spin J : moment orbital total : J = L+ S (couplage Russell-Saunders) Cas de l’électron libre E libre pas d’orbite L = 0 et J = S D’où : g (e) = 2 (valeur plus précise : 2,00232)](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-38-320.jpg)






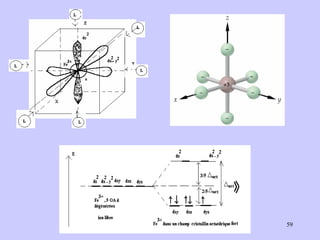
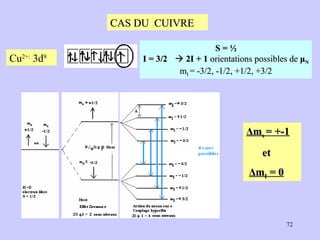
![Exemple : [Fe(CN) 6 ] 3- et [Fe(H 2 O) 6 ] 3+ Fe 3+ : 3d 5 Fe 3+ : ion libre (pas de ligands) 3dz 2 , 3dx 2 -y 2 , 3dxy, 3dxz, 3dyz 4s 4px, 4py, 4pz 4dz 2 , 4dx 2 -y 2 , 4dxy, 4dxz, 4dyz μ exp = 1.75 μ B μ th = [q(q+2)] 1/2 μB , q = 1 (1 e. cél.). [Fe(CN) 6 ] 3- avec 1 électron cél. Complexe paramagnétique Signal RPE Cas du complexe [ Fe(CN) 6 ] 3+ Complexes de symétrie octaédrique](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-52-320.jpg)
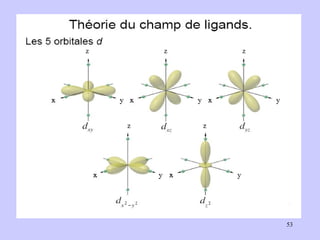
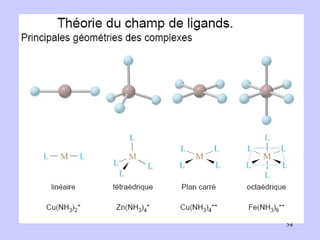
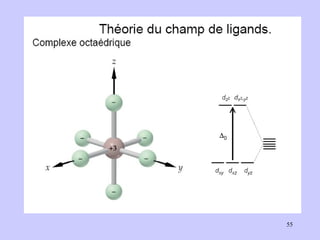

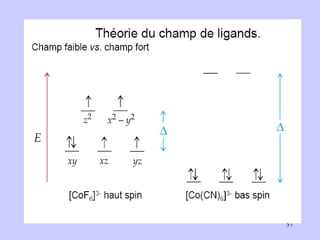
![I - < Br - < Cl - < F - < OH - < C 2 O 4 2- ≈ H 2 O < EDTA 4- < NH 3 < NO - 2 < < CN - < CO CN - Champ cristallin fort Fe 3+ à OA bas spin (BS) Cas du complexe [ Fe(CN) 6 ] 3+](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-58-320.jpg)
![μ exp = 5,80 μ B μ th = [5(5+2)] 1/2 μ B = 5,91 μ B [Fe(H 2 O) 6 ] 3+ avec 5 électrons célibataires Complexe paramagnétique signal RPE possible Cas du complexe [Fe(H 2 O) 6 ] 3+ H 2 O Champ cristallin ≈ faible Fe 3+ à OA haut spin (HS)](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-60-320.jpg)
![Cas du complexe [Fe(H 2 O) 6 ] 3+](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-61-320.jpg)
![Complexes de symétrie tétraédrique et plan carrée Exemple : [Ni(CN 4 )] 2- et [NiCl 4 ] 2- [NiCl 4 ] 2- , Cl - : ligand faible et Complexe paramagnétique H.S Hybridation sp 3 Complexe tétraédrique](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-62-320.jpg)
![[Ni(CN 4 )] 2- , CN - : ligand fort et Complexe diamagnétique B.S Hybridation dsp 2 Complexe plan carré](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-63-320.jpg)
![Dans le cadre du champ cristallin Symétrie tétraédrique : [NiCl 4 ] 2- , H. S Complexe paramagnétique Les ligands ne pointent vers aucune O.A d Mais sont plus près des O.A d dirigées vers le milieu des arêtes (a/2) que vers celles dirigées vers le centre des faces (a(2) 1/2 ) O.A d déstabilisées ( dxy, dxz et dyz ) t2g E augmentée O.A d stabilisées dz 2 , dx 2 -y 2 eg E abaissée](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-64-320.jpg)
![Symétrie plan carrée : [Ni(CN 4 )] 2- , B. S Complexe diamagnétique](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-65-320.jpg)
![Théorie du champ cristallin: Explication de la couleur Transition d-d , complexe octaédrique d'élément de transition (t 2g e g ) Absorption de photon de la lumière visible [400 nm - 800 nm] Exemple : [Ti(H 2 O) 6 ] 3+ Ti 3+ : 3d 1](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-66-320.jpg)
![Détermination de oct oct = h = hc/ = (6,62 10 -34 J.s).(3.00 10 8 m.s -1 )/ (510. 10 -9 m) = 3,88 10 -19 J pour 1 mole d'ions [Ti(H 2 O) 6 ] 3+ oct = (3,88 10-19 J). (6,02 10 23 ions/mol) = 234.10 3 J.mol-1 = 234 KJ.mol -1 En nombre d'onde: oct = 1/ = 1/ 510 10 -7 cm = 19 607 cm -1 Pour 1 ligand H 2 O oct = (19 607)/6 = 3268 cm -1 On peut comparer la force des ligands: I - < Br - < Cl - < F - < OH - < C 2 O 4 2- ≈ H 2 O < EDTA 4- < NH 3 < CN - < CO](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-67-320.jpg)




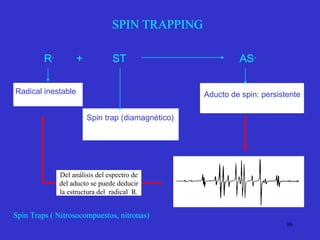
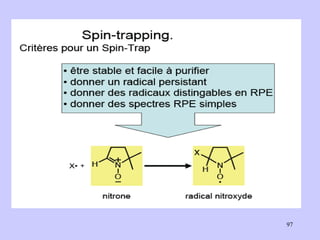
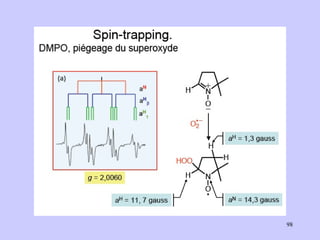



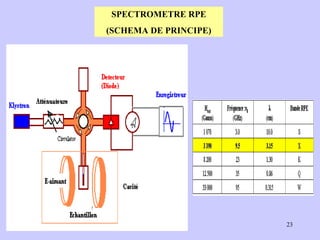
![Aspect quantitative de la RPE appareil à 2 cavités (Echantillon + Etalon) Enregistrement dans les mêmes conditions Échantillon [spins]? I(échantillon) connue Étalon [spins] connue I(etalon) connue I (signal ) [centres paramagnétiques]](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-111-320.jpg)

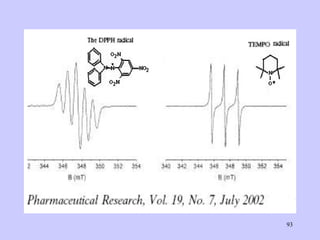
![BIBLIOGRAPHIE * Electron spin resonance by Dr. Phil Rieger, Brown University, 2005 * La résonance paramagnétique électronique, A. KASTLER (Lauréat du Prix Nobel), Dunod, Paris, 1968. * La résonance paramagnétique électronique, M.CHE, D.OLIVIER, L. BONNEVOIT, P. MERIAUNDEAU, 1980 * Chimie générale, M.Garric, Dunod University, 1976 * © 1999 International Consultative Group on Food Irradiation Report. * Journal officiel de l'union européenne (11-3-2003) * Electron spin resonance studies of some irradiated pharmaceuticals M. Gibella et al.; Radiation Physics and Chemistry ; 58(2000)69-76.[1] M. Le Bars, A. Bouroche, L'ionisation dans l'industrie agroalimentaire , Editions INRA, 1998. * L. Saint-Lèbe, J. Raffi, Le traitement ionisant des aliments , Cah. Nutr. Diét., 30, 1995, 117-123. * Comité Mixte d'Experts OMS (Organisation mondiale pour la Santé), FAO (Food and Agricultural * * * * * Organization), AIEA (Agence Internationale pour l'Energie Atomique), Salubrité des aliments irradiés, Ser. Rap. Techn. N°659, OMS, Genève, 1981. * J. Raffi, J-J. Belliardo, Potential new methods in identification of irradiated food , CCE, EUR 13331 EN, 1991. * Rapport scientifique, E. Marchioni (Faculty of pharmacy, strasbourg), H. Delincée (Institute of Nutrutional Physiology, Karlsrushe), 2002. * Doctorat, A. MARFAK, Radiolyse gamma des flavonoides Etude de leur réactivité avec les radicaux issus des alcools : formation des depsides.Université de Limoge, France, 2003. * Spectrométrie RPE, IMACSEN, PHILIPE TUREK , DESS. p:// * Pharmaceutical Research, Vol. 19, N° 7, July 2002. * Etude toxicologique transfrantalière destinée à évaluer le risque encouru lors de la consommation d’aliments gras ionisés; Rapport final/Schlussbericht INTERREG II/ Projet N° 3.171; 2002. * RPE, principe et applications biomédicales, R. DEBUYST et al. LOUVAIN MED. 118: 205-213, 1999. * Facts on Food Irradiation,International Consultative Group on Food Irradiation (ICGFI), 1999](https://image.slidesharecdn.com/cours1rpediapo2008-111203165219-phpapp01/85/Cours-1-rpe-diapo-2008-114-320.jpg)