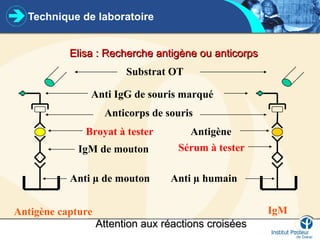
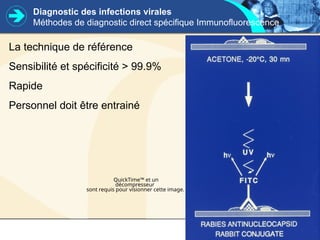
Ce cours sur la virologie couvre les méthodes d'étude et de diagnostic des virus, incluant la culture cellulaire, la détection virale, et l'analyse de l'acide nucléique et des protéines virales. Il retrace également l'historique des découvertes et des techniques virologiques, ainsi que l'importance de la qualité des échantillons pour un diagnostic précis des infections virales. Les méthodes diagnostiques incluent PCR, sérologie et culture virale, chaque technique ayant ses avantages et limitations en fonction des échantillons et des pathogènes ciblés.