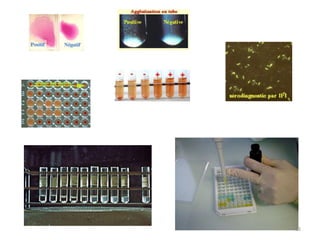
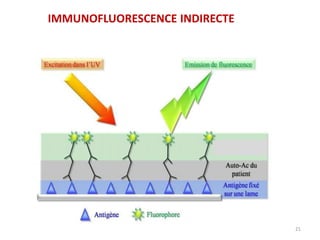
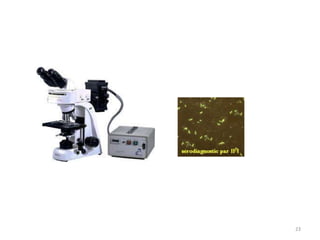
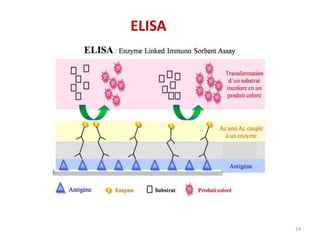
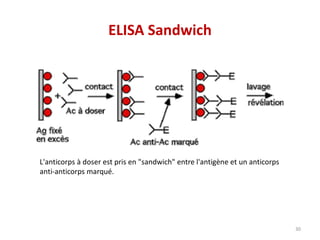
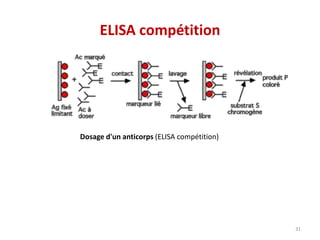
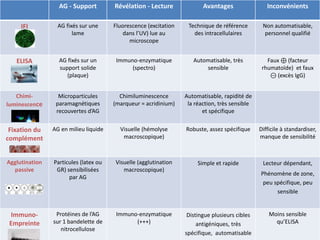
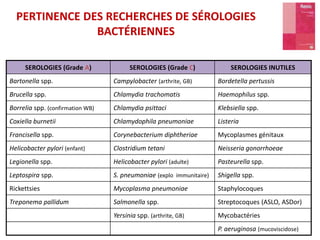
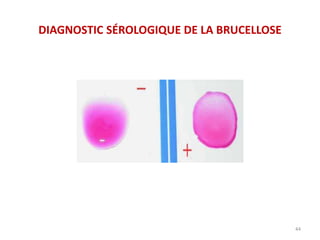
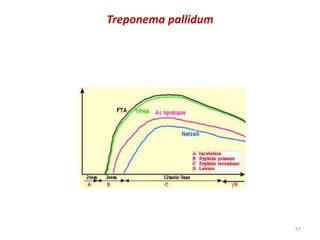
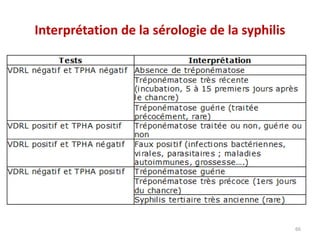
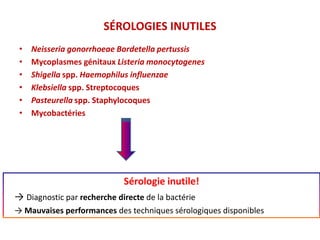
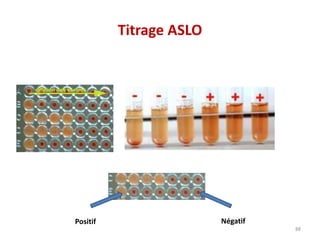
Le document traite du diagnostic sérologique en bactériologie, en expliquant les méthodes de diagnostic direct et indirect, ainsi que les techniques comme l'ELISA et l'immunofluorescence. Il souligne les défis d'interprétation des résultats sérologiques en raison de la variabilité des anticorps et des réactions croisées, tout en mentionnant l'importance de la sérologie dans le suivi thérapeutique et les enquêtes épidémiologiques. Il est détaillé aussi les spécificités des sérologies pour différentes bactéries et les principes des techniques utilisées.