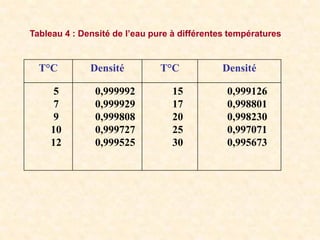
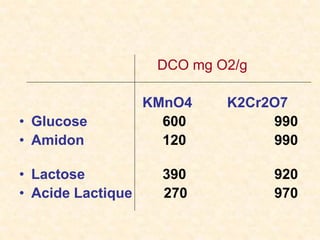
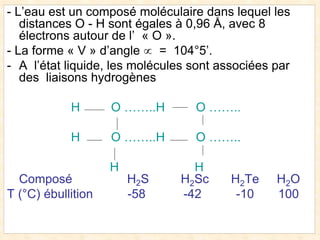
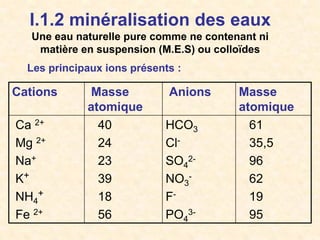
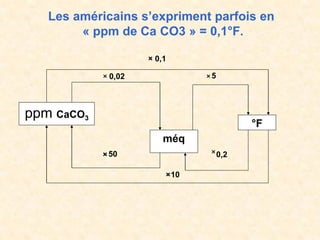
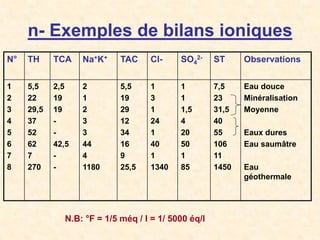
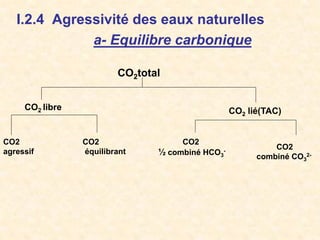
Le document traite de la chimie de l'eau et des paramètres de pollution, en abordant la composition des eaux naturelles, les mesures physico-chimiques, et les principaux indicateurs de pollution tels que la demande biochimique en oxygène et le carbone organique total. Les sources de pollution, incluant les rejets urbains, industriels et agricoles, ainsi que les impacts des différentes substances sur la qualité de l'eau, sont également discutées. En conclusion, la pollution de l'eau est majoritairement causée par des activités humaines, obscurcissant ainsi son utilisation potable.





![a-Titre alcalimétrique (TA) :
TA est défini par l’équation :
TA = [OH-] + [CO3
2-]
b-Titre alcalimétrique complet (TAC)
défini par l’équation :
TAC = [OH-] + [CO3
2-] + [H CO3
-]
c-Titre hydrotimétrique (TH)
dureté de l’eau, mesurée par
TH = TCa + TMg](https://image.slidesharecdn.com/293083259-chimie-de-l-eau-240927171406-9dbdf4e2/85/293083259-Chimie-de-l-eau-pdf-9-320.jpg)











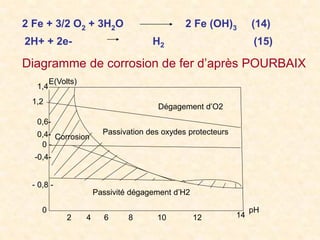
![I.2.5 Corrosivité des eaux naturelles
a-Principe de la corrosion
la destruction chimique ou électrochimique d’un métal
par le milieu ambiant
• A l’anode
M Mn+ + ne (9)
son potentiel d’électrode étant défini par la relation :
E = E° ( M n+ /M) + 0,06 /n log [M n+].
• A La cathode
H+ + e ½ H2 (10)
On définit un potentiel d’électrode E’ = -0,06 pH?
La réaction qui se passe dans la solution est bien
représentée par l’équation globale.
M + nH+ n/2 H2 + M n+ (11)](https://image.slidesharecdn.com/293083259-chimie-de-l-eau-240927171406-9dbdf4e2/85/293083259-Chimie-de-l-eau-pdf-23-320.jpg)