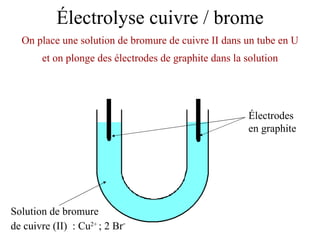
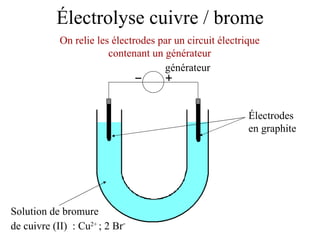
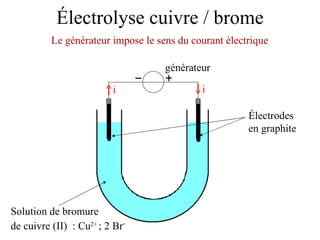
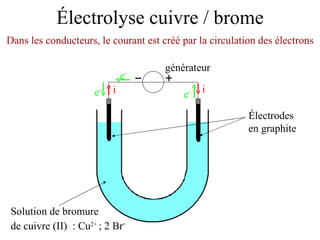
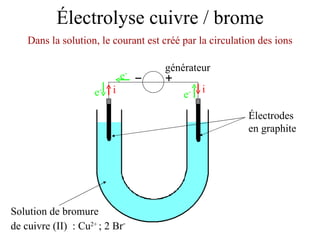
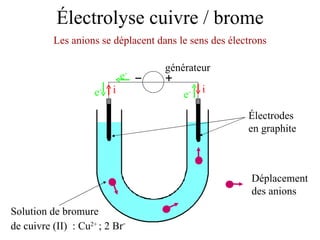
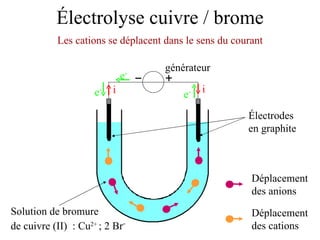
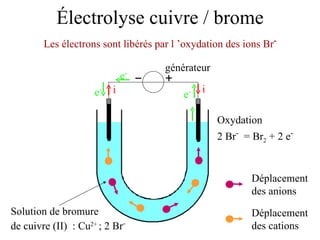
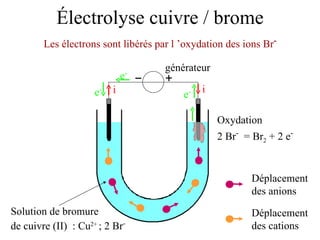
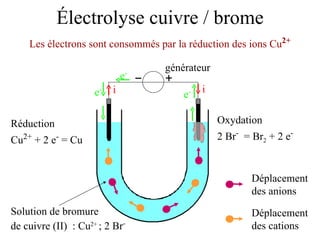
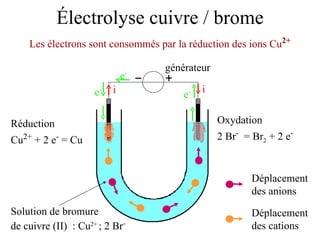
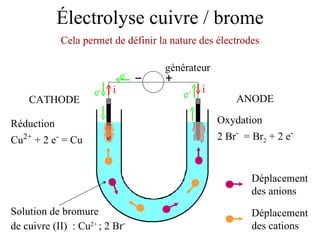
Le document traite de l'électrolyse du bromure de cuivre (II) en utilisant des électrodes en graphite. Il décrit les processus d'oxydation et de réduction qui se produisent aux électrodes, avec des équations chimiques associées illustrant la formation de brome et de cuivre. L'anode et la cathode sont définies selon leur rôle respectif dans ces réactions électrochimiques.