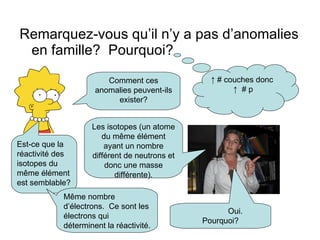
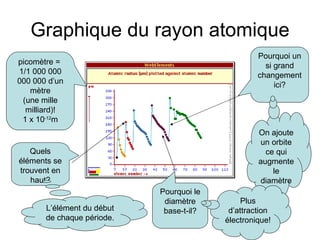
Le tableau périodique, développé par Mendeleïev, classe les éléments selon leur masse atomique et leurs propriétés similaires, bien que désormais les éléments soient organisés par numéro atomique. Les propriétés chimiques et physiques des éléments varient de manière périodique lorsqu'on suit leur numéro atomique. Le document traite également des anomalies, des isotopes, de la réactivité et des tendances du tableau périodique, soulignant divers concepts clés en chimie.