Le document est une référence sur les traitements du VIH, rédigé par des pharmaciennes et soutenu par divers professionnels de santé. Il couvre des aspects tels que les calculs de fonction rénale, les effets indésirables des antirétroviraux, ainsi que les dosages pour adultes et enfants. Une mise en garde est incluse, précisant que les informations doivent être validées par des professionnels de santé et que l'auteur ne peut être tenu responsable des conséquences d'une utilisation inappropriée des renseignements fournis.



![4
Calculs de la fonction rénale et de la fonction hépatique
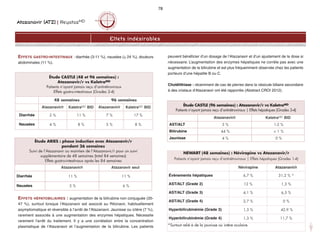
TFGest (ml/min/1,73 m2) =
175 x [créatinine sérique (umol/L) /88,4]-1,154 x (âge)-0,203 x
(0,742 si femme) x (1,21 si AA)
TFGest : taux de filtration glomérulaire estimée
AA = afro-américain
Des calculateurs Cockcroft-Gault/MDRD sont disponibles au lien suivant :
www.kidney.org/professionals/kdoqi/GFR_calculator.cfm
Mise en garde : Cockcroft-Gault et MDRD
v Ces deux équations de TFG ne donnent pas de bons résultats chez les individus
qui présentent une fonction rénale normale ou près de la normale. Elles sont
plus précises chez les patients qui présentent un TFG faible.
v MDRD est plus précise lorsque le taux de filtration est < 60 cc/min. La formule de
Cockcroft-Gault demeure utile pour adapter les doses de médicaments puisqu’elle
est utilisée dans plusieurs monographies.
v De plus, il faut savoir qu'elles n'ont pas été validées auprès de patients porteurs
du VIH et pour toutes les races.
v Elles ne s'utilisent que pour les patients ayant une fonction rénale stable et ne
jouent aucun rôle en cas d'insuffisance rénale aiguë.
v Il est possible que les équations de TFG ne soient pas fiables pour les patients
qui prennent des suppléments de créatinine, dont la consommation de viande
varie beaucoup ou qui présentent des altérations de masse musculaire ou de
phénotypes, notamment l'amyotrophie, une malnutrition importante et l'obésité.
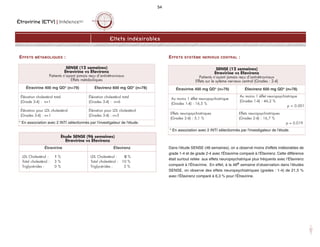
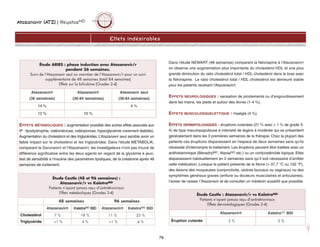
Stade Description
TFGest
(mL/min/1,73m2)
I Anomalie échographie, hématurie ou protéinurie > 90
II Faible diminution du TFG 60-89
III Diminution modérée du TFG 30-59
IV Diminution importante du TFG 15-29
V Insuffisance rénale < 15 (ou dialyse)
2. Équation MDRD
CALCUL DE LA CLAIRANCE À LA CRÉATININE (mL/min)
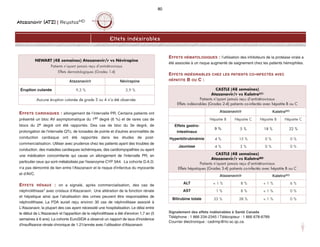
1. Équation de Cockcroft-Gault
Homme :
(140 - âge) x poids (kg) x 60 ou (140 - âge) x poids (kg)
49 x créatinine sérique (umol/L) créatinine sérique (umol/L) x 0,8
Femme :
(140 – âge) x poids (kg) x 0,85 x 60 ou (140 - âge) x poids (kg) x 0,85
49 x créatinine sérique (umol/L) créatinine sérique (umol/L) x 0,8
4. Collecte urinaire de 24 heures
Une collecte urinaire de 24 heures bien exécutée permet une estimation plus précise du TFG. Par contre, selon les experts est peu souvent fait en raison de la difficulté et la variabilité
d'exécution par les patients.
3. Équation CKD-epi
L'équation CKD-epi offre une meilleure estimation du TFG que la formule MDRD, spécialement chez les patients avec un TFG plus élevé.](https://image.slidesharecdn.com/guidear2006-160110153324/85/Guide-ar2006-4-320.jpg)