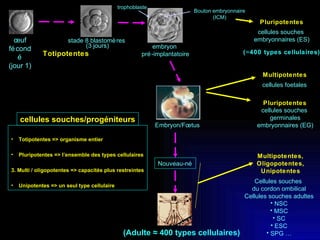
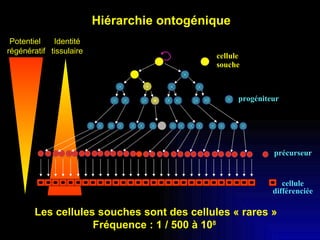
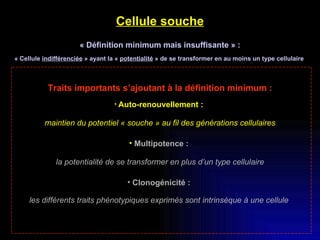
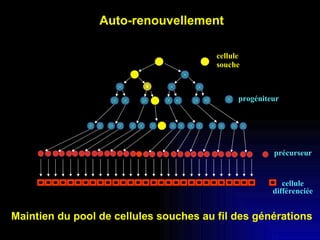
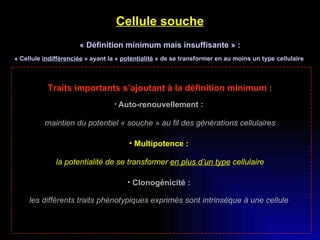
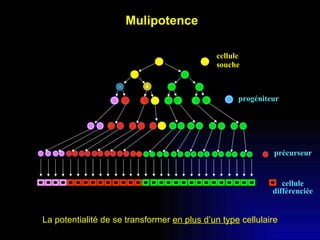
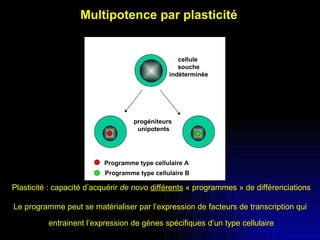
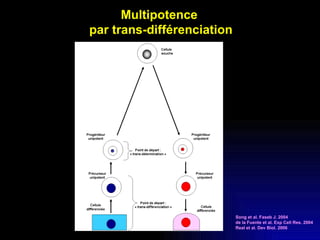
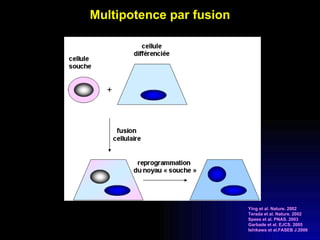
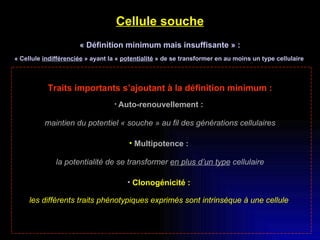
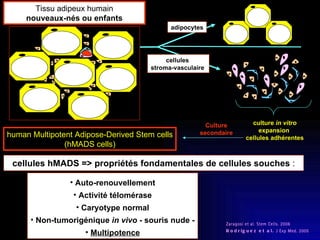
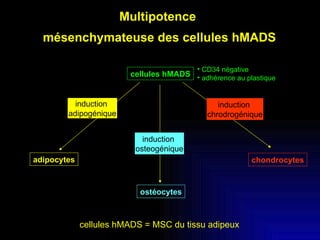
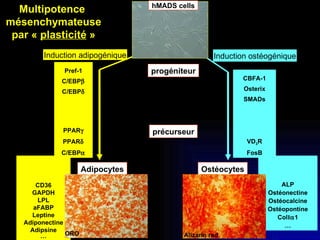
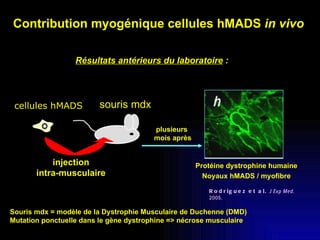
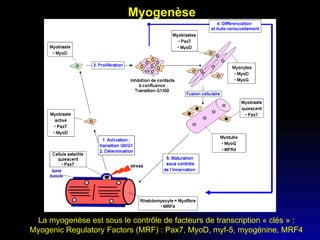
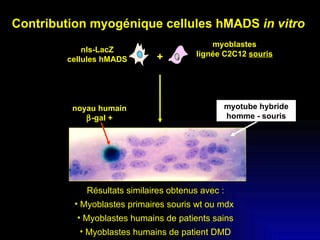
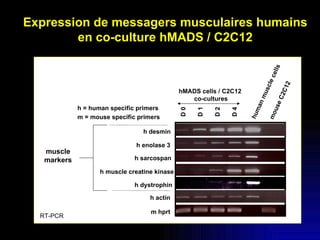
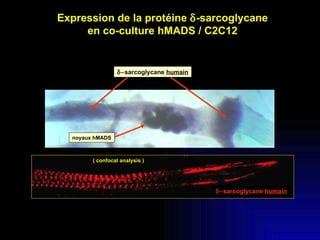
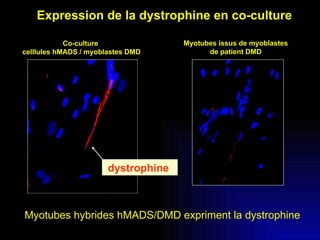
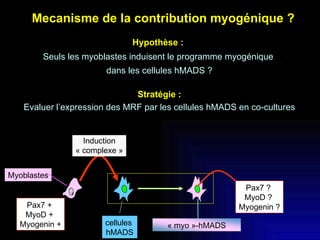
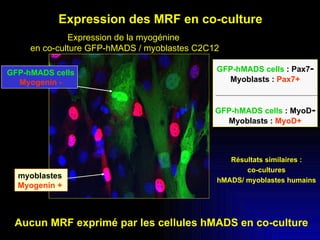
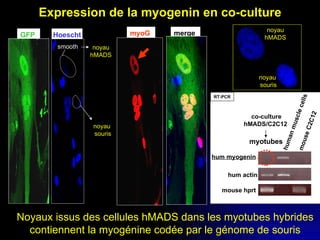
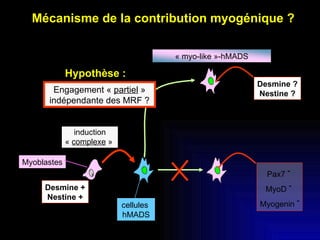
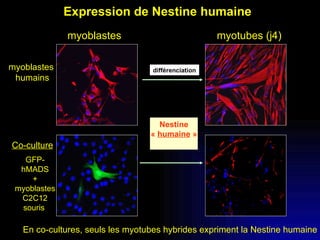
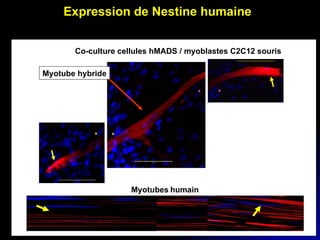
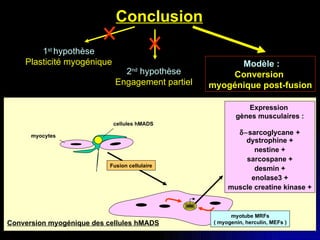
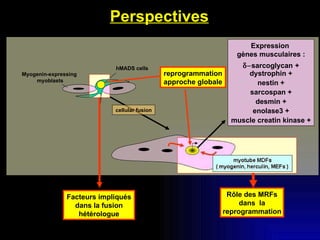
Ce document examine les cellules souches mésenchymateuses dérivées du tissu adipeux humain et leur potentiel myogénique, en mettant en lumière leur capacité à se différencier en divers types cellulaires, y compris les myoblastes. Il analyse les mécanismes régulant la myogenèse, notamment les facteurs de transcription essentiels, et présente des résultats expérimentaux révélant que ces cellules peuvent contribuer à la formation de myotubes hybrides avec des myoblastes. La recherche soutient l'idée que les cellules souches mésenchymateuses ont une plasticité myogénique intrinsèque, impliquant une conversion myogénique potentielle par fusion cellulaire.