Zarski cytokines 2013
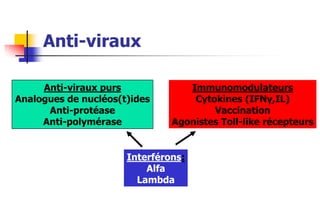
- 1. Anti-viraux Anti-viraux purs Immunomodulateurs Analogues de nucléos(t)ides Cytokines (IFNγ,IL) Anti-protéase Vaccination Anti-polymérase Agonistes Toll-like récepteurs Interférons: Alfa Lambda
- 2. Antiviraux Hépatite B Hépatite C Interféron α Interféron α Autres interférons Analogues de: Ribavirine Nucléosides Anti-protéases Nucléotides Anti-polymérase: NS5b Nucléosidiques Non nucléosidiques Anti-NS5a Inhibiteurs d’entrée Agonistes Toll-like récepteurs
- 3. INTERFERONS . Protéines ou glycoprotéines . Spécifiques de l’espèce . Agissant sur la cellule cible (récepteur) . Expression de certains gènes : synthèse des ARNm et protéines
- 4. INTERFERONS Caractéristiques IFN INF IFN Cellules Leucocytaire Fibroblastique Lympho T (lympho T et B macrophage) Structure G20 Kda GP 20 Kda GP 17 Kda 165 AA 165 AA 146 AA Chromosome 9 p 21 9 p 21 12 Inducteurs virus, virus, Antigènes polyribonucléotides polyribonucléotides Mitogènes des lympho T
- 5. INTERFERONS Récepteurs . Spécifiques présent à la surface des cellules . et # . Haute constance d’affinité . Nombre de sites récepteurs faible
- 6. INTERFERON Récepteur / (IFNAR) + IFN IFN IFN IFNAR2 IFNAR1 IFNAR1 = 110 -130 Kd Intermédiaire IFNAR2 = 55 - 95 Kd
- 8. INTERFERON Mécanisme d’action P Tyk-2 STAT-1 STAT-1 STAT-1 IFN P P P STAT-2 STAT-2 48 STAT ISRE Jak-1 Tyk-2 et Jak-1 =Tyrosines kinases STAT S = facteurs de transcription ISRE = Interferon Sensitive Response Element
- 9. IFN and Type 1 IFNs ISGF: Interferon-Stimulated Genes Factor IRF: Interferon Regulatory Factor ISRE: Interferon Stimulated Response Element ISG: Interferon-Stimulated Genes
- 10. INTERFERONS 1°) Expression induite : - 2 ’5 ’ OAS - Protéine kinase, Mx - CMH I et II - Beta 2 microglobuline - Xanthine oxydase - Récepteur du TNF 2°) Expression inhibée - c-myc, c-fos - collagène
- 11. INTERFERON Action des principales enzymes induites : 1°) 2’ 5’ oligoadénylate synthétase : - catalyse synthèse d’oligomères d’adénine - oligomères activent endonucléase - destruction des ARN viraux 2°) Protéine kinase P1 - Sérine thréonine kinase - initiation de la synthèse protéique
- 12. INTERFERON ALPHA Effet immunomodulateur HLA II IFN IL12 Th0 rIL12 IFN Th1 Th2 Activation Activation CTL NK Cellule B Prolifération IFN IFN IFN HLA I Anticorps
- 13. INTERFERON ALPHA Effet anti-fibrosant In vitro et in vivo? ( TGF béta 1) Effet anti-oncogénique Direct: anti-prolifératif anti-oncogénique Indirect: protéines virales, immunomodulation, anti-fibrosant et anti-angiogénèse
- 14. CHARACTERISTIQUES DES IFN-PEG PEG-IFN 2a PEG-IFN 2b Taille: 40kDa Taille: 12kDa Structure: branché Structure: linéaire Dose fixe Dose adaptée au poids Clairance hépatique Clairance rénale
- 15. Les nouveaux interférons Interféron Laboratoire Phase Commentaires Albinterféron Novartis 3 S2:non; S4: en cours Oméga-IFN Intarcia Th 2a O-IFN+RBV:36% IFNa2b-XL Scherring/ 2a =Pega2b Flamel Infergen-XL Flamel 1 Locteron Biolex Th 2a Lambda-IFN Zymogenetics/BMS 3 Effets II Efficacité≠
- 16. Antiviraux Hépatite B Hépatite C Interféron α Interféron α Autres interférons Analogues de: Ribavirine Nucléosides Anti-protéases Nucléotides Anti-polymérase: Nucléosidiques Non nucléosidiques Inhibiteurs d’entrée Agonistes Toll-like récepteurs
- 17. ADN VHB sous IFN-PEG a2a et séroconversion HBe 12 Traitement Suivi ADN VHB moyen (log10 cp/ml) 10 Pas de séroconversion HBe à S72 (n = 184) 8 6 -3,8 log10 cp/ml Séroconversion HBe à S72 (n = 87) 4 10 000 cp/ml -5,84 log10 cp/ml 2,30 log10 cp/ml 2 Séroconversion HBe et HBs 33 % 29 % 38 % à S72 0 (n = 8) Période de Survenue séroconversion HBe 0 12 24 36 48 60 72 Semaines EASL 2006 – T. Piratvisuth, abstract 49
- 18. MOLECULES ANTIVIRALES Analogues de nucléos(t)ides Guanine Phosphonates de nucléosides acycliques . Entécavir . Adéfovir, Ténofovir Adénine Analogues de pyrophosphates . Ara-MP . Foscarnet Analogues Analogues lévogyres de nucléosides fluorés . Lamivudine (Cytidine) . FIAU . FTC ou Emtricitabine (Cytidine) (Uracyl) . L-dT (Telbivudine) . LFD4C (Cytidine)
- 19. ANALOGUES DE NUCLEOSIDES Efficacité Bonne captation cellulaire Phosphorylation par les kinases cellulaires (tri- phosphate) Degré de compétition avec les nucléosides naturels endo-cellulaires Efficacité de la liaison à la polymérase virale et de son incorporation dans la chaine d ’ADN naissante
- 20. INITIATION G Entécavir A T A AAA 5’ 3’
- 21. TRANSLOCATION et ELONGATION Lamivudine Emtricitabine Entécavir POL AATG AAA 5’ DR1 3’ Adéfovir Ténofovir
- 22. Réduction de l’ADN du VHB après 1 an de Traitement ADV1 ADV2 LAM3 LdT3 ETV4 TDF5 10 mg 30 mg 0 Réduction de l’ADN du VHB -1 -2 à 1 an (Log10) -3 -3,5 -4 -4,8 -5 -5,5 -6 -6,5 -6,4 -6,9 -7 -8 Patients AgHBe-positifs *Données issues d’études indépendantes, ne permettant pas de comparaisons (populations différentes, valeurs initiales de charges virales et méthodes de quantifications de l’ADN du VHB différentes) 1Hepsera [RCP]; 2Marcellin et al., N Engl J Med 2003, 348: 808-16; 3Sebivio [RCP]; 4Baraclude [RCP]. 5Heathcote et al., AASLD 2007, abstract LB6; Fontana R.J., Gastroenterlogy 2009, 136(2):389-92.
- 23. Déterminer la réponse antivirale Réduction du niveau d’ADN VHB2 Patients naïfs de nucléoside AgHBe(+) et AgHBe(-) Median HBV DNA VHB (copies/mL) 10 11 11 n=87 Réduction médiane d’ADN (Copies/mL) 10 n=40 10 n=151 9 10 n=144 8 10 n=97 7 10 n=82 6 10 n=27 5 10 n=13 4 10 ) 3 10 2 10 0 24 36 48 72 Semaines de traitement 1. Tenney DJ, et al. Antimicrob Agents Chemother. 2007;51:902–911. 2. Colonno R. ISVHLD 2006; Oral presentation O200
- 24. ENTECAVIR O Analogue de la guanine N NH Inhibiteur sélectif et puissant du CH 2 N NH 2 N VHB OH (EC50 = 4 nM, Ki = 1 nM) Agit à 3 niveaux de la polymérase: OH Initiation Synthèse ADN-dépendante Reverse transcription
- 25. ENTECAVIR :ADN VHB Dosing 3,5 3 2,5 Placebo 2 0.05 mg 0.1 mg 1,5 0.5 mg 1 1.0 mg 0,5 0 0 1 2 3 4 6 8 Weeks
- 26. TENOFOVIR Analogue nucléotidique (monophosphorylé) Utilisé dans le VIH depuis 2000 Inhibe l’ADN Polymérase Terminateur de chaine Plus efficace que l’Adéfovir Aucune mutation de résistance à 6 ans Tolérance rénale bonne mais: Clairance à surveiller Hypophosphorémie
- 27. Adefovir Entecavir Tenofovir Lamivudine Telbivudine Vertige 1/10 Gastrointesti nal Très fréquent: Céphalées Expert Panel Italian Guidelines STI review 2009;2:14-27. Malaise TOLERANCE Dyspnée Rash fréquent: Thrombocyto 1/100-1/1,000 penie Acidose lactique Hypophosph atemie Rare: Cl Créatinine Nécrose tubulaire 1/1,000-1/10,000 Pancreatite CPK Myalgia, rhabdomyolyse >1/10,000 Très rare: Peripheral neuropathy Amylase, lipase
- 28. MUTATIONS DE RESISTANCE Terminal spacer Pol/RT RNaseH protein 1 183 349 692 845 a.a. (rt1) (rt 344) GVGLSPFLLA YMDD I(G) II(F) A B C D E V173L LAM / FTC L180M M204I/V ADV A181V N236T ETV T184G S202I M250V LdT M204I Allen Hepatology 1998, Delaney J Virol 2003, Angus Gastroenterology 2003, Villeneuve J Hepatol 2003, Lai AASLD 2003, Colonno HepDart 2003
- 29. Antiviraux Hépatite B Hépatite C Interféron α Interféron α Autres interférons Analogues de: Ribavirine Nucléosides Anti-protéases Nucléotides Anti-polymérase: Nucléosidiques Non nucléosidiques Inhibiteurs d’entrée Agonistes Toll-like récepteurs
- 30. Cinétique de l‘ARN VHC 14 3 MU 12 5 MU x 106 copies/mL 10 10 MU 8 6 4 2 0 0 24 48 Hours Lam et al., Hepatology. 1997;26:226-231
- 31. ARN VHC Effet de la Pégylation IFN TIW 12 IFN + RBV 10 PEG IFN Daily IFN 8 6 4 2 0 0 24 48 Temps
- 32. Cinétique virale: Apport de la ribavirine Feld et al, Gastroenterology 2010
- 33. 31 Cinétique virale en fonction du génotype de l’IL28B (génotype 1) Caucasiens Afro-américains 0 0 TT -2,0 -2,0 CT TT -4,0 CT -4,0 CC -6,0 CC -6,0 4 2 4 12 4 2 4 12 Semaines Semaines Hispaniques 0 La réduction de la charge virale est associée -2,0 indépendamment au génotype de l’IL28B et à TT l’ethnie -4,0 CT (p < 0,0001) CC -6,0 4 2 4 12 Semaines Thompson et al, Gastroenterology 2010
- 34. RIBAVIRINE Analogue nucléosidique de la purine Forme active: ribavirine triphosphate Effet anti-viral: Réplication virale: faible ( 0,3 Log) 2 ’5 ’ OAS en synergie avec l ’interféron Inhibition de l ’IMPDH Réduction de synthèse de GTP Mutations possibles (NS5b)
- 35. MECANISME D’ACTION DE LA RIBAVIRINE Glutamine PRA Ribavirine IMP (Inosine monophosphate) Ribavirine - MP XMP (Acide xanthylique) GMP, GDP, GTP
- 37. ARN VHC Mono vs. Bithérapie 14 IFN TIW 12 IFN+RBV 10 8 6 4 2 0 0 24 48 Temps
- 38. Un déficit génétique protégeant de l’anémie Permet de détecter ≈ 30% des patients présentant un risque négligeable de développer une anémie Aide à la décision clinique chez les patients à haut risque d’anémie
- 39. Inosine triphosphatase (ITPase) 2 variants fonctionnels Chromosome 20 Exon 2: rs1127354 Intron 2: rs7270101* Polymorphisme: diminution de Hb à S4 Allèle mineur protège * Non retrouvé au Japon Thompson et al, Gastroenterology 2010 Ochi et al, Gastroenterology 2010
- 40. Taribavirine
- 41. TARIBAVIRINE 60 52 50 47 42 41 41 40 40 TBV 20mg 31 30 TBV 25mg 30 25 TBV 30mg 20 19 RBV 8-1400 13 11 10 0 Sem 12 Sem 24 Anémie S24 ARN VHC<39UI/ml Poordard et al, Hepatology 2010 Anémie:<10g/dl
- 42. Organisation du génome VHC et maturation de la polyprotéine 3’NCR 5’NCR Cadre de lecture TRADUCTION Protéines structurales Protéines non-structurales MATURATION Host signal peptide Host signal NS2/3 NS3/4A peptidase protéase peptidase protéase C E1 E2 p7 NS2 NS3 4A NS4B NS5A NS5B Serine ARN-polymérase Glycoprotéines Protéase Hélicase Core protéase ARN-dépendante d’enveloppe CofacteurSeri ne protéase NCR : Non Coding Region Asselah T et al. Liver International 2009;29(s1):57-67.
- 44. Cibles Thérapeutiques NS3 Site de fixation du substrat de la protéase Site de fixation de NS4A Site de fixation du substrat de la protéase Site catalytique de la protéase Site d’attachement à la membrane de la protéase-hélicase Site de fixation du zinc Site de fixation du substrat de la protéase NS2/NS3 Pawlotsky JM, Chevaliez S, McHutchison JG, Gastroenterology 2007
- 45. Télaprévir : mode d’action Telaprévir Inhibe le clivage de la polyprotéine Host signal peptide Host signal NS2/3 NS3/4A peptidase peptidase protéase protéase C E1 E2 p7 NS2 NS3 4A NS4B NS5A NS5B Serine ARN-polymérase Glycoprotéines Protéase Hélicase Core protéase ARN-dépendante d’enveloppe CofacteurSeri ne protéase • Télaprévir se lie à la protéase NS3A/4A empêchant la maturation de la polyprotéine NS et inhibant la réplication du VHC Adapté: Asselah T et al. Liver International 2009;29(s1):57-67.
- 48. RESISTANCE Inhibiteurs de protéase 36 54 155 156 168 170 Valine Threonine Arginine Alanine Aspartate Valine Sauvage (V) (T) (R) (A) (D) (V) Telaprevir V36A/M T54A R155K/T A156V/T Boceprevir T54A A156S/T V170A ITMN-191 A156S/V D168A/V/E Adapte de Kieffer et al. Hepatology. 2007;46(3):631-639. Graphic courtesy of Dr Ira M. Jacobson.
- 49. Les résistances TVR + PEG-IFN + RBV : Patients ayant perdu Temps médian de perdre la détection du variant 1,0 Variant* la détection de perte du variant avant de détectabilité Probabilité cumulative 0,8 la fin d’étude 0,6 V36A/M 69 % (37/54) 36 semaines Médiane 0,4 T54A 86 % (12/14) 13 semaines NS3*36 0,2 NS3*54 NS3*155 R155K/T 60 % (36/60) 44 semaines NS3*156 0,0 V36M+R155K A156S/T/V 80 % (4/5) 24 semaines 0 10 20 30 40 50 60 70 Temps (semaines) V36M+R155K 54 % (22/41) 46 semaines * Variations non mutuellement exclusives. AASLD 2010 – D’après Kieffer TL et al., abstract LB11 actualisé.
- 50. Les pistes thérapeutiques Les anti-protéases de 2ème génération TMC-435 (Siméprevir) RG-7227 (Danoprévir) BI-201335 (Faldaprévir) MK-7009 (Vaniprévir) BMS-650032 (Asunaprévir) GS-9256 et GS-9451 ABT-450 Autres…
- 51. La trithérapie avec IP 2ème génération: naifs génotype 1
- 52. Les molécules sont plus puissantes et vont plus vites: comparaison des 2 molécules MSD PCR (-) à S12 96 100 90 80 69 70 60 50 S 12 40 30 20 10 0 Bocéprévir MK-5172
- 53. La trithérapie avec IP 2ème génération: patients en échec
- 54. Cibles Thérapeutiques RdRp site NNI A site NNI C site NNI B site NNI D Site catalytique (Pawlotsky JM, Chevaliez S, McHutchison JG, Gastroenterology 2007;132:1979-98)
- 55. Inhibiteurs de la Polymérase Nucléosidiques: Non nucléosidiques NS5b: Liaison à 1/5 sites allostériques Changement conformationnel du Analogues de substrats site catalytique naturels Génotype spécifique NS5b: très conservée Sélection de mutants Tout génotype Haute barrière de résistance NS5a:
- 56. Inhibiteurs de la Polymérase Analogues nucléosidiques: Inhibiteurs non nucléosidiques NS5b GS-9190 (Gilead) R7128 (Roche) BMS-790052 (BMS) PF-00868554 ou Filibuvir (Pfizer) IDX184 (Idenix) ANA-598 (Anadys Pharmaceuticals) PSI-7977 (Sofosbuvir, Gilead) BI 207127 (Boehringer) VCH-916 et -222 NS5a: BMS 790052
- 57. Les pistes thérapeutiques Les anti-polymérases (NS5B) Nucléotidiques R-7128 GS-7977 (Sofosbuvir) Méricitabine Non nucléotidiques BI-207127 Filibuvir GS-9190 ABT-333 et-072
- 58. Anti-polymérases Nucléosidiques Non nucléosidiques
- 59. La trithérapie avec les I.polymérases 12/ PR 24 12/PR 48 24/PR 24 24/PR 48 90 90 76 57 51 Méricitabine Sofosbuvir
- 60. Etude ATOMIC : Sofosbuvir/PEG IFN/RBV chez patients naïfs G1, 4 et 6 ARN VHC indétectable (%) SOF + PEG + RBV SOF + PEG + RBV SOF + PEG + RBV 12 sem. 24 sem. 12 + 12 sem. 12 sem: (n=52) 24 sem: (n=126) 12+12 sem (n=155) Hassanein T, Etats Unis, AASLD 2012, Abs. 230 actualisé
- 61. Patients Génotype 1: schéma avec interféron: tri- ou quadrithérapie? Durée Médicaments n RVS sem Asunaprevir Daclatasvir PEG/RBV 24 21 RN G 1a/b 95 % Danoprevir/R PEG/RBV 24 41 RP G1a/b 56 % 41 RN et RP G1b 100 % Danoprevir/R Méricitabine PEG/RBV 24 50 RN et RP G1a 74 % RN:Répondeur nul; RP:répondeur partiel
- 62. Daclatasvir+Asunaprévir+PR chez les répondeurs nuls génotype 1 Réponse virologique 100 100 90 90* 80 Patients (%) 64 60 60 46 46 40 36 20 7 6 5 9 5 10 4 9 0 n = 11 10 11 10 11 10 11 10 S24 S4 S12 RVS Fin TTT Groupe A : BMS-790052 + BMS-650032 Groupe B : BMS-790052 + BMS-650032 + PEG-IFNα/RBV *Un patient a eu un ARN < 25 UI/ml détectable au suivi S24 et était < 10 UI/ml (indétectable 35 jours après ) Lok A et al . N Engl J Med 2012; 366: 216-224.
- 63. Efficacité de la quadrithérapie chez les G1 répondeurs nuls 100 100 100 100 100 95 95 * 90 95 ASV 200 mg x 2/j + DCV + PEG/RBV ARN VHC < 25 UI/ml (%) 80 ASV 200 mg x 1/j + DCV+ PEG/RBV 60 Barres pleines < LDD (10 UI) 40 Barres hachurées Détectable et < LDQ (25 UI) 20 75 71 95 95 90 100 90 95 0 n= 20 21 20 21 20 21 20 21 S4 S12 S24 RVS 24 Fin traitement * 2 patients ont rechuté : 1 à la semaine 4 et 1 à la semaine 12 • G1 (88 % G1a), IL28B CT/TT (100 %) Lok A, Etats-Unis, AASLD 2012, Abs. 79 actualisé
- 64. Les associations sans interféron Bithérapie Trithérapie Quadrithérapie
- 65. Patients Génotype 1: schémas sans interféron Durée Médicaments n RVS sem Naïfs (ARN- à S2) Telaprevir VX 222 RBV 12 23 G1a 67 % 23 G1b 100 % 30 Naïfs G1a 43 % Faldaprevir BI 207127 RBV 28 48 Naïfs G1b 85 % Asunaprevir Daclatasvir 24 18 RN G1b 78 % 23 RP G1b 39 % Danoprevir/R Méricitabine RBV 24 31 RN G1b 55 % 79 Naïfs G1a/b 97 % ABT 450/R ABT 267 ABT 333 RBV 12 45 NR G1a/b 93 % 15 Daclatasvir Sofosbuvir ±RBV 24 Naïfs G1a/b 93-100 % 15 BMS791 Asunaprevir Daclatasvir 12-24 16 Naïfs G1a/b 94 % 325 Sofosbuvir RBV 24 25 Naïfs G1a/b 56-72 % *RN: Répondeur nul; RP: Répondeur partiel
- 66. INFORM-1 : première étude testant l’association d’une antiprotéase et d’un inhibiteur de l’ARN polymérase dans le VHC Diminution médiane de la charge virale Réponse virologique 7 à J14 Mediane log10 ARN VHC (log UI/ml) % 100 6 88 RG7227 + PEG-IFN + RBV RG7227/RG7128 (naïfs) 80 5 63 RG7227/RG7128 (NRC) 60 50 4 3 40 25 20 Naïfs Naïfs 2 NRC NRC LID 1 0 0 1 3 5 7 9 11 13 < 15 UI/ml < 43 UI/ml Jours LID : limite inférieure de détection < 15 UI/ml RG7128 1000 mg x 2/j + RG7227 900 mg x 2/j Non répondeurs complets NRC = réduction ARN VHC < 1 log10 UI/ml à S4 ou < 2 log10 UI/ml à S12 Gane EJ.et all, Lancet 2010
- 67. INFORM 1 : association orale inhibiteur de protéase et inhibiteur de polymérase Réponse virologique Jour 13 100 100 Semaine 4 88 80 Semaine 12 80 ARN-VHC indétectable (%) 75 63 60 60 53 40 38 38 33 25 20 20 13 13 0 0 (n = 8) (n = 8) (n = 8) (n = 39) (n = 10) NR nuls NR non nuls Naïfs Naïfs poolés Placebo F E G BCDG Gane et al, Lancet 2010
- 68. Asunaprévir+Daclatasvir: G1b répondeurs nuls 100 100 89 89 89 85 ARN VHC < 25 UI/ml (%) 78 80 70 70 ASV 200 mg x 2/j + DCV 65 65 60 ASV 200 mg x 1/j + DCV 40 Barres pleines < LDD (10 UI) 20 Barres hachurées Détectable et < LDQ (25 UI) 67 55 89 65 83 65 89 65 78 65 0 n= 18 20 18 20 18 20 18 20 18 20 S4 S12 S24 RVS 4 RVS 12 Fin traitement • 8 patients ont présenté un échappement ( : 2, : 6), tous ont reçu du PR en plus : 1 a rechuté à 4 sem. ( ) • Parmi les 4 patients ( ) sans RVS12, 2 étaient < LDD ensuite Lok A, Etats-Unis, AASLD 2012, Abs. 79 actualisé
- 69. Etude ELECTRON : génotypes 2/3 RVS selon les schémas thérapeutiques incluant sofosbuvir S0 S4 S8 S12 (n = 10) SOF + PEG + RBV 100 % RVS 24 (n = 10) SOF + PEG + RBV SOF + RBV 100 % RVS 24 (n = 9) SOF + PEG + RBV SOF + RBV 100 % RVS 24 (n = 11) SOF + RBV 100 % RVS 24 (n = 10) SOF 60 % RVS 24 (n = 10) SOF + dose RBV réduite à 800 mg 60 % RVS 8 (n = 25) SOF + RBV 64 % RVS 12 (n = 10) SOF + PEG + RBV 100 % RVS 24 (n = 25) SOF + RBV (patients déjà traités) 68 % RVS 12 SOF : sofosbuvir PEG : PEG IFN alfa RBV : ribavirine Gane EJ, Nouvelle Zélande, AASLD 2012, Abs. 229 actualisé
- 70. Trithérapie sans IFN (daclatasvir + asunaprevir + BMS-791325): génotype 1 naïfs 24 semaines de traitement 12 semaines de traitement Groupe 1 (n = 16) Groupe 2 (n = 16) 100 94 94 94 100 88 100 94 94 100 100 80 80 ARN VHC < LDQ (%) ARN VHC < LDQ (%) 60 60 40 40 20 20 0 0 4 12 Fin RVS4 4 12 Fin RVS4 RVS12 de traitement de traitement ARN VHC < LDQTD ou TND (< 25 UI/ml) ARN VHC < LDQTD ou TND (< 25 UI/ml) Donnée manquante Donnée manquante Everson GT, Etats-Unis, AASLD 2012, Abs. LB3 actualisé
- 71. Daclatasvir et Sofosbuvir+/- ribavirine chez des malades naïfs de génotypes 1, 2 et 3 Efficacité chez les patients de génotype 1 93 % < 25 UI 100 SOF LI + DCV ARN VHC < 25 UI/ml(%) 80 DCV + SOF 60 DCV + SOF + RBV 40 20 87 93 73 100 100 100 100 100 100 100 100 100 93 100 100 % < 10 UI N= 0 15 14 15 15 14 15 15 14 15 15 14 15 15 14 15 S4 Fin du traitement RVS4 RVS12 RVS24 Sulkowski M, Etats-Unis, AASLD 2012, Abs. LB2 actualisé
- 72. Quadrithérapie sans IFN (ABT-450/r + ABT-333 + ABT-267 + RBV) Réponse Virologique Soutenue (S12) 100 97,5 93,3 89,9 88,9 Pourcentage de patients (ITT) 87,5 85,4 87,3 80 ayant une RVS 12 60 40 20 n= 80 41 79 79 79 45 45 0 ABT-450 ABT-450 ABT-450 ABT-450 ABT-450 ABT-450 ABT-450 ABT-267 ABT-267 ABT-267 ABT-267 ABT-267 ABT-267 ABT-333 ABT-333 ABT-333 ABT-333 ABT-333 RBV RBV RBV RBV RBV RBV 8 sem. 12 sem. 12 sem. Patients Naïfs Patients Répondeurs Nuls Kowdley KV, Etat-Unis, AASLD 2012, Abs. LB1 actualisé
- 73. Inhibition de la cible cellulaire de l’hôte 1. Inhibiteurs d’entrée virale (AC) • CD81? • Scavenger récepteur BI (SR-BI) 2. Inhibiteurs de la biosynthèse des lipides • Statines? • Sécrétion des VLDL? 3. Inhibiteurs de la cyclophiline B • Interagit avec la région C-terminale de NS5B • Debio-025 4. Insulino-résistance 5. Récepteurs nucléaires • PPAR • Farnésoid X récepteur (FXR) • Œstrogène récepteur (ESR)
- 74. Agonistes des Toll-like récepteurs TLR + + + + Lympho B Cellules dendritiques IFN alfa IP-10 2’5’OAS
- 75. Inhibiteurs de la cyclophiline Débio 025* *Interagit avec NS5b, sans propriétés anti-calcineurine Per os
- 76. Inhibiteurs de la cyclophiline Débio 025* Flisiak et al, Hepatology 2009
- 77. Antiviraux Hépatite B Hépatite C Interféron α Interféron α Autres interférons Analogues de: Ribavirine Nucléosides Anti-protéases Nucléotides Anti-polymérase: Nucléosidiques Non nucléosidiques Inhibiteurs d’entrée Agonistes Toll-like récepteurs