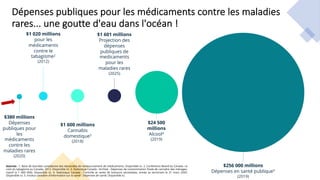
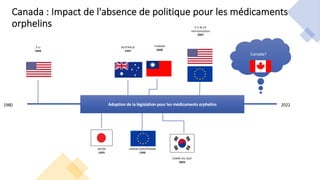
Le webinaire sur les maladies rares, présenté par Durhane Wong-Rieger et Jonathan Pratt, vise à renforcer l'accès à l'information et aux traitements pour les personnes atteintes de maladies rares. Il met en lumière l'importance de la recherche, de l'éducation et de la collaboration entre associations, patients et chercheurs pour améliorer la qualité de vie et l'accès aux médicaments. Des stratégies et des investissements sont nécessaires pour relever les défis d'accès et de remboursement des traitements, ainsi que pour promouvoir la recherche et l'innovation dans ce domaine.