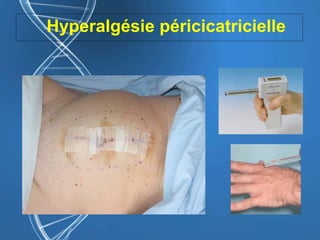
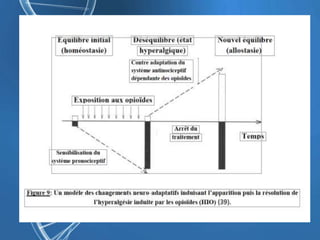
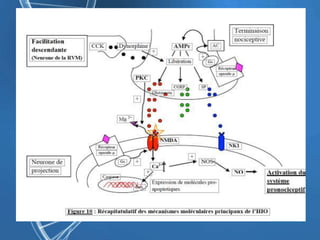
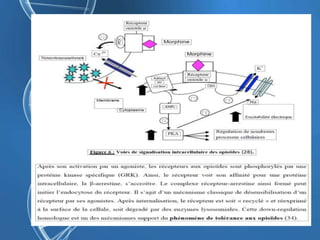
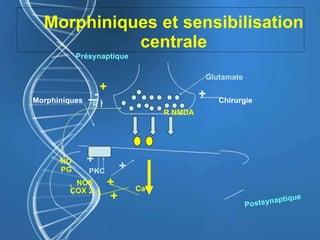
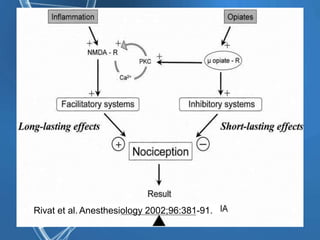
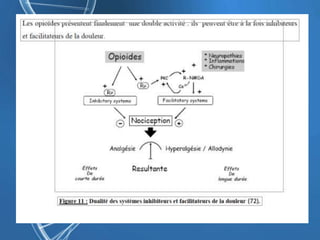
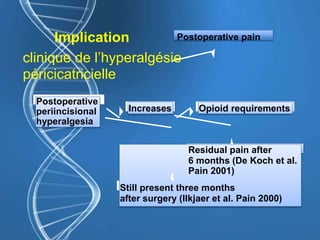
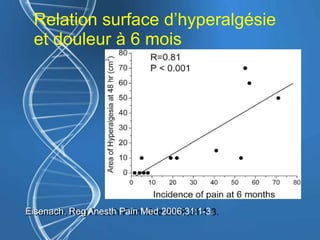
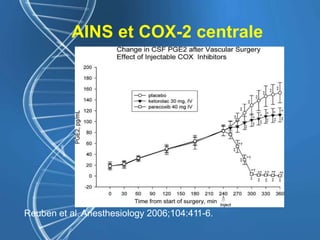
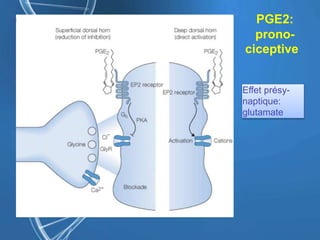
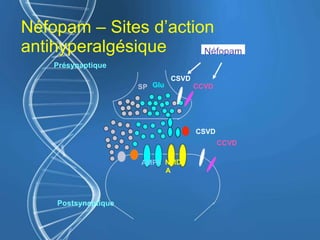
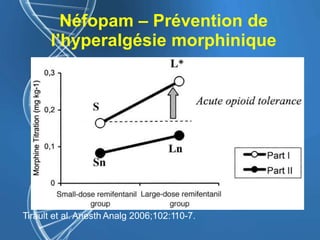
Le document présente un cas clinique d'une femme de 62 ans souffrant d'hyperalgésie induite par les opioïdes après une arthroplastie du genou, avec un protocole d'anesthésie et une gestion de la douleur durant et après l'opération. Il explore les phénomènes d'hyperalgésie péricicatricielle, les facteurs influençant la douleur postopératoire et les options pour une analgésie multimodale. Les recommandations incluent l'utilisation de traitements antihyperalgésiques et la justification d'une analgésie équilibrée pour prévenir une escalade de la douleur.























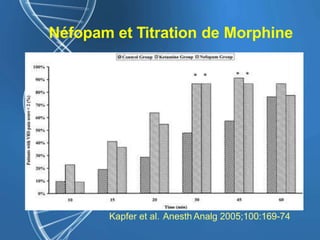

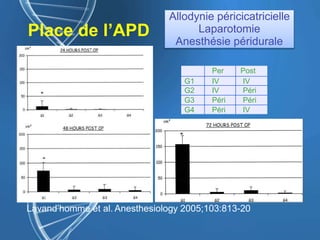

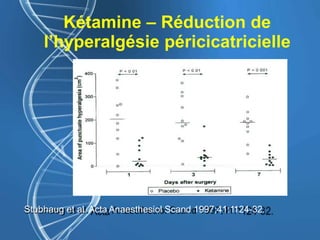


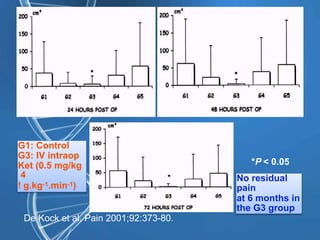
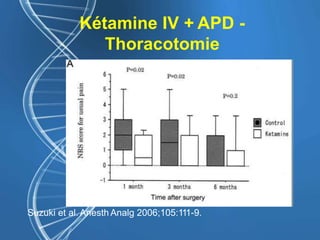

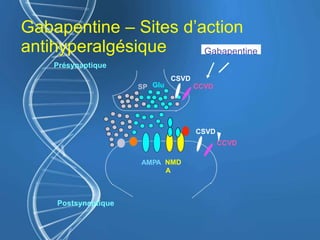
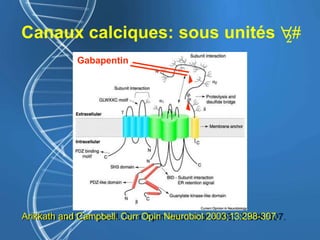

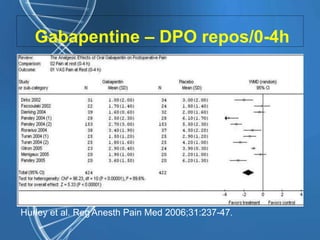
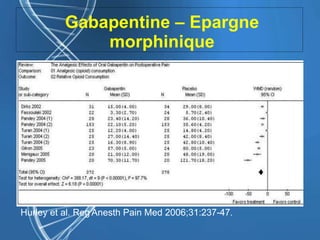
![Gabapentine - DPO
• Epargne morphinique (-30%, [IC 95%
33-26] P < 0,0001)
• Réduction des vomissements (OR =
0,58 [IC 95% 0,39-0,87] P = 0,008)
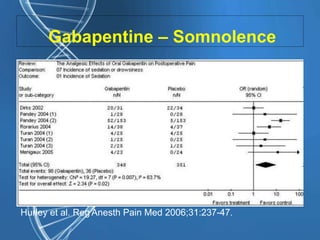
• Augmentation de l’incidence de la
sédation (OR = 3,00 [2,00-4,51] P <
0,0001) et des vertiges (OR = 1,80
[1,14-2,82] P = 0,01).
17 études
Bossard et al. AFAR 2006;25:S136.](https://image.slidesharecdn.com/hyperalgsie-140419114014-phpapp02/85/L-Hyperalgesie-secondaire-expliquee-a-partir-d-un-cas-clinique-54-320.jpg)