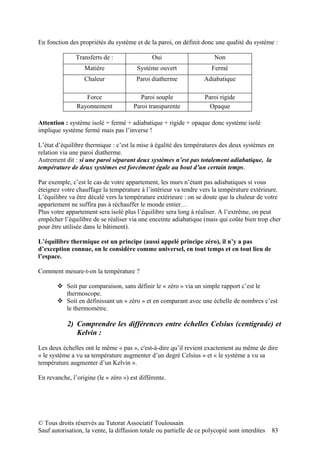
Le document est un polycopié du tutorat associatif toulousain pour l'année universitaire 2010-2011, fournissant des compléments de cours sur la physique, notamment la mécanique quantique, les interactions fondamentales et la thermodynamique. Il explique les concepts de quantification de l'énergie, d'opérateurs en mécanique quantique, ainsi que l'indiscernabilité des particules et les relations d'indétermination de Heisenberg. L'ensemble vise à aider les étudiants à mieux comprendre les bases de la biophysique et des méthodes d'exploration des systèmes.
























![Le calcul que fait tout le monde dans la vie en général est : final - initial.
Dans le cas présent, les systèmes étudiés perdent de l’énergie : comme nous, c’est
cette énergie qui nous intéresse (connaître l’énergie d’un rayon C émis lors d’un
examen radiologique pour ne pas trop irradier le patient par exemple), on préfère la
compter en positif.
On calcule donc : - ΔMIF = DDM = initial - final
Le défaut de masse représente la masse « perdue » ou libérée lors de la formation du
noyau. On pourrait écrire la réaction de cette façon:
Z protons + N neutrons → Noyau ( + DDM)
Z mp + N mn = M + DDM
DDM = Z mp + N mn – M
M = Z mp + N mn – DDM
Ici l’énergie de liaison B (B pour bind = lier) vaut DDMc² (pour défaut de masse
2
c ). Le DDM peut etre exprimé en u, mais l'exprimer en MeV/c² permettra d'avoir
directement accès à l'énergie de liaison.
B = DDM c²
L'excès de masse
Il y a une légère différence entre la masse (A u) théorique et la masse M(A,Z)
réelle. L'excès de masse représente cette différence entre la masse théorique, qui est
sensiblement donnée par le même chiffre que le nombre A de nucléon (voir
précédemment) : M ≈ A u, et la masse réelle.
En effet, comme vu précédemment, on fait d'abord une première approximation
concernant la masse du nucléon, puis une deuxième sur le défaut de masse, et une
troisième sur la masse de l'atome M.
En réalité, M = M + Zme- – | El |
M = Z mp + N mn – DDM + Zme- – | El |
Dans cette formule, El représente l'énergie de liaison des électrons au noyau. (pour la
justification, cf chapitre IV - Instabilité du noyau).
L'excès de masse EM rend compte de l'ensemble des approximations sur la masse de
l'atome.
EM = [M(A,Z) - A] u
= [M(A,Z) - A] * 931,5 MeV / c²
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 25](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-25-320.jpg)
![Pourquoi vous dire tout ça ? Parce que dans les exercices qui concerneront le
chapitre instabilité, l’énergie libérée par une désintégration d’un père en un fils se
calculera en faisant la différence entre M(père) et M(fils).
Parfois (pour rigoler) on ne vous donnera pas M(père) et M(fils) mais EM(père) et
EM(fils). Il faut les utiliser de la même façon.
Exemple: pour une désintégration X(A,Z) → Y(A,Z+1) + β-
DDEM = EM(X) - EM(Y)
= ( [ M X(A,Z) - A] - [ M Y(A,Z+1) - A] )
= [ M X(A,Z) - M Y(A,Z+1)]
= DD M
Les A s’annulent, en effet dans β+/-, les A du père et du fils sont égaux, ils sont
isobares !
DDEM est la différence des excès de masse entre l'atome père et l'atome fils, et
DD M la différence des masses des atomes.
Attention: le DDM (défaut de masse du noyau) est toujours positif, alors que le
DDEM (ou le DDM , c'est pareil) peut etre positif ou négatif.
5 - Force de cohésion nucléaire
C’est le résiduel de l’interaction forte à l’extérieur des nucléons, comme on l’a vu
dans le second chapitre.
Elle est plus liante pour une paire neutron/proton où les spins sont parallèles que
pour une paire proton/proton ou encore neutron/neutron où les spins sont antiparallèles
(du fait du principe d'exclusion de Pauli).
Elle est médiée par les mésons (qui sont des bosons) :
Les mésons de spin impair vont provoquer la répulsion entre nucléons qui
s’approchent à moins de 0,5 Fermi. Les mésons de spin pair vont provoquer une
attraction entre nucléons qui s’éloignent de plus de 1Fermi.
Ceci permet de garder une distance constante de 0,5 à 1 Fermi entre les nucléons !
Remarque : Comme on l’a dit précédemment, la cohésion nucléaire et la cohésion
des atomes dans une molécule ayant la même forme de résiduel d’interaction, elles
vont agir de la même manière (répulsion entre 2 atomes trop proches ; attraction s' ils
sont trop loin, d’où la stabilité de longueur des liaisons interatomiques dans une
molécule ; seule différence, l’interaction forte étant plus forte que l’interaction
électromagnétique, l’architecture d’une molécule sera plus labile que celle d’un
noyau).
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 26](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-26-320.jpg)

![7 - Modélisation du noyau
a) Justification
Une explication complexe vous est ici exposée : ce qu’il faut en retenir, c’est la
conséquence à savoir que le volume du noyau est proportionnel au nombre de
nucléons (puisque ceux-ci restent tous à distance à peu près égale comme nous l’avons
vu, de 0,5 à 1 Fermi).
V = kA or V = kR3 donc R = kA1/3 → R = roA1/3
On retiendra surtout la formule suivante : R= 1,3 A1/3
Il s’agit du rayon du noyau : le rayon de l’atome dépend du nombre de couches du
cortège électronique et du nombre d'électrons qui se trouvent dans cette couche,
puisque, comme vous l’avez vu en chimie, plus il y a d’électrons dans une couche,
plus ils se tassent.
Notion d’épaisseur de peau : e = 2,4 +/- 0,3 F (Fermi) : Il s’agit de la couche de
nucléons qui va se trouver en surface. Pour un noyau à 4 nucléons (He), tous les
nucléons sont en surface ; pour un noyau de 100 nucléons, la proportion sera moindre
→ cette notion n’est pas négligeable, nous verrons pourquoi quand nous parlerons de
l’énergie superficielle.
b) Composantes de B (voir le polycopié du Dr Victor)
B = av A - as A2/3 - ac (Z2 / A1/3) - aa [(N-Z)2/A] + c
Cette relation est à connaître par cœur !
Dans cette relation, tous les av, as,... sont des constantes qu'on arrange un peu pour que
la relation fonctionne: le reste de la formule est explicable par la logique.
Moyen mnémotechnique : « Avahasa de Troie en a assez des Zèbres carrés sur
les arbres tiers. Ah, ah ! La haine moindre des zèbres carrés sur les arbres. »
Sachant qu’ av A est le seul nombre positif, (avec éventuellement c, mais qui n'est pas
très important numériquement) tout le reste est perdu et est donc en négatif. Nous
allons voir pourquoi.
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 28](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-28-320.jpg)

![-Energie d’asymétrie : -aa [(N-Z)²/A]
L’idéal est de faire des couples de nucléons (N-P) (voir 5- Force de cohésion
nucléaire), donc si N = Z, N-Z = 0 et l’énergie de liaison n’est pas diminuée.
Pour des noyaux plus gros, il y a plus de neutrons (voir ligne de stabilité page 29)
donc N-Z > 0
En le rapportant à A, on se dit que « d’accord, il n’y a pas autant de n que de p,
mais vous comprenez bien, monsieur, qu’avec un gros noyau comme ça je ne peux pas
contenir tous mes protons (qui se repoussent) sans un minimum de neutrons
excédentaires ! »…
En divisant par A, je relativise le nombre de neutrons excédentaires par rapport à la
taille du noyau : Pour un nombre de A moyen, l’énergie de liaison est maximisée par
N = Z, puis quand A dépasse un certain seuil, l’énergie de liaison est maximisée par N
> Z.
Tout cela explique 99% de l’énergie de liaison B : le reste s’éclaircit grâce à :
-Energie d’appariement c :
Quand les nucléons identiques peuvent se coupler par paire, de l’énergie de liaison
est récupérée : ces deux nucléons vont tourner l’un autour de l’autre, perdant ainsi de
l’énergie cinétique, récupérée en énergie de liaison.
Il faut en fait remarquer que dans l’énergie d’asymétrie ci-dessus, les couples n-p
s’établissent en fait sous la forme 2n-2p.
On parle de noyaux pair/pair par exemple. Cette appellation fait référence
respectivement à Z/N (Z pair / N pair).
Pour les noyaux pair/pair, Z/2 protons s’apparient à Z/2 protons, idem pour les
neutrons.
On obtient Z/2 couples de protons et N/2 couples de neutrons, qui vont s’apparier
pour faire baisser l’énergie d’asymétrie.
Pour les noyaux pair/impair et impair/pair, il y aura dans le premier cas un neutron
solitaire, dans le 2ème cas un proton solitaire.
Enfin, dans les noyaux impair/impair il y aura 1 neutron et 1 proton solitaires, ce qui
est très déstabilisant : seuls 5 noyaux vont adopter cette configuration (il s’agit de
H(2,1) Li(6,3), B(10,5), N(14,7) et Ta(180,73) : cette configuration marche tout de
même pour ces cinq, puisqu’ils peuvent faire des paires n-p au lieu des paires 2n-2p)
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 30](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-30-320.jpg)

![IV – Instabilité du noyau
Introduction
La radio activité consiste en l’évolution d’un état initial instable ou excité vers un
état final de plus basse énergie, et donc plus stable.
C’est la désintégration d’un noyau père en un noyau fils avec émission d’une ou
plusieurs particules, ou encore la désexcitation d’un noyau de l'état excité vers son état
fondamental.
Pour que ce processus ait lieu, il faut que le noyau père X ait une masse supérieure à
celle du fils Y. Ainsi, la désintégration de X en Y doit libérer de la matière.
Du fait de l'équivalence masse-énergie, donnée par la relation E=mc2, on peut aussi
dire que la réaction doit libérer de l'énergie, ou que l'énergie disponible doit etre
positive. A cette condition seulement, la réaction est possible. Si vous voulez savoir si
X1 peut devenir X2 par exemple, il faut déjà vérifier cette condition. Si la différence
d’énergie (ou différence de masse, c'est pareil) entre ces deux noyaux est négative,
alors le passage de X1 à X2 par désintégration est impossible.
Pour une désintégration : X → Y + particules + Q
Q est l'énergie disponible à la fin de la désintégration
Q = initial - final
Q = M(X)c² - [M(Y)c² + M(particule)c²]
Q>0
Remarque: on peut aussi parler de différence de masse, c'est équivalent. On a alors:
DDM = M(X) – [M(Y) + M(particules)]
Q = DDM c²
Attention: içi, DDM représente la différence de masse entre l'état initial et l'état final,
et non le défaut de masse.
Cette énergie disponible Q va se répartir en énergie de recul du noyau fils (on la
néglige), en énergie cinétique des particules, et essentiellement en énergie d’excitation
du noyau fils (en effet, la plupart du temps, les noyaux fils naissent à l'état excités, ils
vont ensuite se desexciter en perdant encore de l'énergie).
En fait, on estime qu’une source radioactive (SRA) est constituée d’atomes et
non de noyaux : on écrit le bilan en fonction des masses atomiques M et plus en
fonction des masses nucléaires M:
M (A,Z) = M(A,Z) + Zme - | El |
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 32](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-32-320.jpg)





![C’est un processus d’interaction forte (voir chapitre 3) pour désexciter un noyau
ayant un nombre de nucléons et de protons trop élevé: l'interaction forte est donc
responsable de la fission nucléaire!
Dans ce type de transformation, on a par exemple: X → Y + Z, Y et Z étant des
noyaux fils et non de petites particules comme les α ou les β-.
3- Désexcitation par interaction faible
a) Emission β-
A A ___ 0
X → Y + β + νe (notation de l'antineutrino= l'antiparticule
-
Z Z+1 -1 du neutrino)
L’électron et l’antineutrino sont créés puisqu’ils ne préexistent pas dans le noyau.
Le neutron libre est émetteur β - : n → p + e- , car la masse du neutron est
supérieure à celle du proton.
Ce qu’il se passe : A (nombre de nucléon) restant identique (transformation
isobarique), un neutron devient proton dans le noyau.
La composition en quarks du boson change : udd devient uud : un d devient u sous
l’influence du boson intermédiaire W - (β -), c'est à dire que le neutron devient proton;
ceci provoque l’émission d’un électron et d’un antineutrino.
Le noyau, passe de Z protons à Z+1 protons.
Z+1 est le nouveau numéro atomique, qui indique le nombre de protons et d’électrons.
Mais le cortège électronique n'est pas encore affecté par ce changement:
L’atome fils va donc être temporairement ionisé:
M (Y) = M [Y(A, Z+1)] + Zme (et non (Z+1)me)
masse de l'atome fils = masse du noyau à Z+1 protons + masse des Z électrons
(l'énergie de liaison du cortège électronique au noyau est négligée)
Donc M (Y) = M (A,Z+1) - me
Il manque un électron à l’atome fils.
Si l’on fait le bilan :
Noyau X + électrons de X → Noyau Y + électrons de Y + β-
M(A,Z)c² + Zmec² → M(A,Z+1)c² + Zmec² + mec²
Q β- = M(A ,Z)c² - M(A,Z+1)c² - mec² Q β- = DDMc² - mec²
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 38](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-38-320.jpg)










![Défaut et excès de masse
Défaut de masse: DDM = Z mp + N mn – M
Excès de masse: EM = [M(A,Z) - A] u
= [M(A,Z) - A] * 931,5 MeV / c²
Différence des excès de masse: DDEM = DD M
Rayon du noyau, énergie de liaison
Rayon du noyau: R = roA1/3 = 1,3A1/3
Energie de liaison: B = DDM c²
= avA - as A2/3 - ac (Z2 / A1/3) - aa [(N-Z)2/A] + c
IV - Instabilité du noyau
Généralités
Différence de masse: DDM = masse des particules à l'état initial – masse des particules
à l'état final
Energie libérée par la réaction: Q = DDM c²
Désexcitation de l'atome
Photon X: EX= { Ei – Ef}
Electron Auger: Ee-Auger= { Ei - Ef } - | El |
Donc Ee-Auger= EX - | El |
Désexcitation par interaction électromagnétique
Isomérisme nucléaire Eγ = { EI – EF}
Conversion interne: Ee- = { Ei - Ef } - | El |
Donc Ee-CI = Eγ - | El |
Désexcitation par interaction forte
Emission α : Qα = E(α) + Erecul (négligée)
= DDM c²
Désexcitation par interaction faible
Emission β- : Qβ- = (DDM - me) c²
= (DD M ) c²
Emission β+ :Qβ+ = (DDM - me) c²
= (DDM- 2me) c²
Capture électronique: QCE = DD M c² - | El |
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 49](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-49-320.jpg)








![Correction
QCM 2 : DE
A. Le zinc est obtenu par émission β- du cuivre 64, il possède donc le même nombre de
nucléons A et un proton de plus , soit Z(Cu) + 1 = 30. De plus, le nombre de neutrons
est 35.
B. Même raisonnement en β+, ici le nickel possède le même A mais un proton en
moins, soit Z(Cu) – 1 = 28. Le nombre de neutrons est 36.
C. La désexcitation du cuivre en zinc est une émission β- et non β+.
QCM 3 : CD
A. A = 64 et Z = 29 donc N = 64 -29 = 35, le cuivre 64 est donc un noyau impair-
impair.
E.M. 64Cu = −65 423 keV /c²
B. donc DDEM(Cu–Ni) = (-65423) - (-67098) = +
E.M. 64 Ni = −67 098 keV /c²
1675 keV/c².
C. VRAI. Même méthode qu'en B.
D. Pour une émission β+, E max = DDEM − 1022 keV et
+
E max = 653 keV /c² .
+
E. Pour une émission β-, E max = DDEM donc E max = 578 keV / c² .
+ +
QCM 4 : ABCD
A et B. VRAI. Le modèle des quarks est explicite pour l'émission β-, cf poly du Dr.
Victor.
C. VRAI. On sait que Eγ = +1346 keV/c². Or, DDM(Cu-Ni) = +1675 keV/c²,
donc DDM(Cu-Ni*) = Eε1 = 1675 – 1346 = 329 keV.
QCE = Eν = DDM(Cu-Ni*)c² - |El| = 329 – 9 = 320 keV.
D. VRAI. Un photon d'énergie Eγ = 1346 keV pour la capture électronique, et deux
photons d'énergie Eγ = 511 keV émis lors de l'annihilation du positon issu de la
désexcitation β+.
E. B(Cu) – B(Ni) = [29mp + 35mn + 29me – M(Cu)] - [28mp + 36mn + 28me -
M(Ni)]
= mp – mn + me – DDEM ≈ - 2450 keV.
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 58](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-58-320.jpg)




![Correction
QCM 1: ACE
B. Seuls les fermions obéissent au principe d'exclusion de Pauli.
D. Le principe de causalité est niée par la physique quantique.
QCM 2: AE
B. L'interaction forte est attractive à très courte distance.
C. Sa portée est d'environ 1,5 F.
D. Elle est médiée par les gluons.
QCM 3: BC
A. Le rayon du noyau est proportionnel au nombre de nucléons à la puissance 1/3.
B. VRAI. Rappel: le volume de la sphère est 4/3 πR3.
C. VRAI. Simple application numérique à partir de la formule: R = r0 A1/3
D. L'énergie de surface est proportionnelle à la puissance 2/3 des nucléons.
E. Elle est inversement proportionnelle à la puissance 1/3 du nombre de nucléons.
Pour se rappeler des puissances du nombre de nucléons, il faut bien comprendre qu'en
termes de dimensions, le nombre de nucléons, A, est homogène à un volume [L]3. On
peut écrire A = A3/3 . A partir de là, on retrouve que A1/3 a la dimension d'une longueur,
et A2/3 la dimension d'une surface.
QCM 4: ACD
B. Le noyau d'oxygène a 8 protons soit un de plus que l'azote. Il a 6 neutrons (14-8)
soit un de moins que l'azote.
C. VRAI. On a M(N) = 7mn + 7mp – Bc² donc B = 13144,9-13040,2 = 104,7MeV
D. VRAI. On a M(C) = 6mp + 8mn – B = 7mp + 7mn + mn – mp donc B =
13144,9+1,3-13041,7=104,5MeV
E. On a B = 7mp + 7mn – (mn-mp) – M(O) = 13144,9-1,3-13045,6= 98MeV
donc B/A = 98/14 = 7 MeV.
QCM 5: BCE
A.Une parabole de masse représente une courbe où Z est placé en abscisse et EM en
ordonnée. On aura une parabole correspondant aux noyaux pair-pair et une autre
correspondant aux noyaux impairs-impairs. Ici on a donc deux paraboles : une où sont
présents le carbone 14 et l'oxygène 14 qui sont pairs-pairs; et une avec l'azote 14 qui
est impair-impair.
B. VRAI. L'élément le plus stable a l'excès de masse le plus petit : il s'agit bien de
l'azote.
C. VRAI. L'énergie disponible est : E = ( EM(C) – EM(N) ) * c² = 3,020 – 2,864 =
0,156 MeV
D. VRAI. L'oxygène 14 produit de l'azote 14 par émission β+ .
E. L'énergie disponible est alors égale à : E = ( EM(O) – EM(N) – 1,022 ) * c² =
8,006-2,864-1,022 = 4,12 MeV.
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 63](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-63-320.jpg)

![Correction
QCM 2: BCD
A. La masse de certains bosons vecteurs (le photon, les gluons, le graviton) est nulle,
mais la masse d'autres bosons vecteurs n'est pas nulle (les bosons W+, W- et Z0, les
mésons).
B. VRAI. Ils doivent etre détectables expérimentalement, sinon ce ne sont que de purs
produits théoriques.
C. VRAI. Ils obéissent à la statistique de Bose-Einstein.
D. VRAI. Le photon ne porte pas de charge électrique.
E. Les bosons vecteurs ont un spin entier ou nul.
QCM 3: BD
A. L'excès de masse peut etre positif, nul, ou négatif.
C. et D. L'équivalent énergétique de l'unité de masse atomique s'écrit E(u) = uc² (en
Joules).
E(u) = 1,66.10-27.(3.108)² Joules, ou bien E(u) = 1,66.10-27.c² . 1,6.10-19 eV= 981,5
MeV/c²
E. L'opposé de l'excès de masse ne donne rien du tout. Excès de masse et énergie de
liaison n'ont aucun lien.
QCM 4: ABCE
Amasseéchantillon = M * 24.1020
= 30 u * = 30 * 1,66 . 10-27 * 24.1020 kg = 30 * 1,66 . 10-21 * 24.1020
mg
B. M = M + 15me, donc M = M – 15 me (utiliser les données en MeV / c²).
C. EM = M (u) – A = 29,978 u – 30 = - 0,022 . 931 500 keV / c².
D. massenucléons = 15 (mp + mn + me) * 931,5 - 15 me
E. M = 15 (mp + mn + me) – DDM, donc DDM = [ 29,978 – 15 * 2,016 ] * 931,5
MeV / c²
B = DDM c² = [ 29,978 – 15 * 2,016 ] * 931,5 MeV.
B/A = [ 29,978 – 15 * 2,016 ] * 931,5 / 30 MeV.
QCM 5: ABE
A. VRAI. Ils se répartissent sur la paraboles des noyaux pairs-pairs et impairs-impairs.
B. VRAI. L'élément stable est celui dont l'excès de masse est le plus négatif.
C et D. Les transitions indiquées sont des désintégrations β-.
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 65](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-65-320.jpg)






































![Fonction d’Etat
(U, S, H…)
DTE Non DTE
donc conservative (ex : donc non conservative
U, entropie réversible…) entropie irréversible
6) Connaître la définition de l’énergie libre (F) et de l’enthalpie libre (G) :
Deux relations à connaître :
F = U − TS
Et surtout : ∂ Q r = d [U − F ]
D’où ∂ Q r = dF dans un système isolé dU=0
G=F+PV
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 105](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-105-320.jpg)



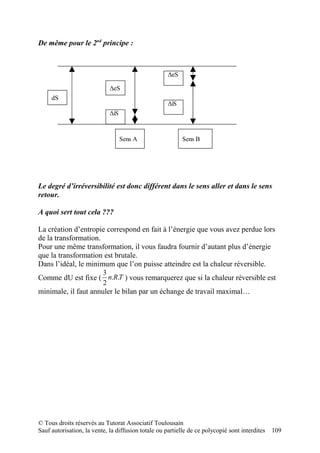








![D) Une force conservative dérive d’une énergie potentielle.
Q.C.M. n°3 :
Méthode :
1) vérifier que la force est conservative (propriété de commutativité)
2) calcul de la fonction primitive
3) calcul du travail entre 2 points
Correction :
1) La force est-elle conservative ?
∂ fx ∂ f y
=
∂y ∂x
Ici, égal à k
2) Fonction primitive :
∫ f x .dx = kxy
∫ f y .dy = kxy
3) Calcul du travail entre deux points :
[kxy] à intégrer entre 2 points, chacun ayant 2 coordonnées.
Calcul des coordonnées, on résout l‘équation avec x=1, puis avec x=9
Pour x=1 : y=6
Pour x=9 : y=10
Donc W= k (90-6) = 84 k
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 118](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-118-320.jpg)
![QCM. 4 :
∂ fx ∂ f y
Force conservative ? = ?
∂y ∂x
∂ fx ∂f
Ici ce n’est pas le cas : = − kx alors que y = − ky donc non DTE.
∂y ∂x
Dans ce cas, la force est dissipative et de fait le travail dépend du chemin suivi.
dy = y ' ( x).dx donc dy = (− 2 x + 3)'.dx = − 2.dx
D’où :
df = f x .dx + f y .dy = − kxy.dx + [ − kxy × (− 2dx)] = − kxy.dx + 2kxy.dx = kxy.dx
= kx × (− 2 x + 3).dx
⇒ df = − 2kx² + 3kx.dx
B B ( 3; − 3)
2 3
Donc W AB = ∫ − 2kx ² + 3kx.dx = − kx 3 + kx ²
A 3 2 A ( 0; 3)
2 3 2 3 27 9
⇒ W AB = − k × 33 + k × 3² − − k × 0 3 + k × 0² = − 18k + k = − k = − 4,5k
3 2 3 2 2 2
Réponse B
Remarque : la résolution de ce genre de QCM est particulièrement complexe. C’est
pourquoi au concours un tel QCM serait probablement formulé de façon différente.
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 119](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-119-320.jpg)
![Question n° 5 :
∂ fx ∂ fy
= donc c’est une force conservative.
∂y ∂x
Fx = ∫ f x .dx = ∫ k ( y + 1).dx = [ kxy + kx]
Fy = ∫ f y .dy = ∫ k ( x − 1).dy = [ kxy − ky ]
[
D’où : W AB = kxy + kx − ky ] B(( +− 4;;++ 23))
A 1
⇒ W AB = [ k × (+ 4) × (+ 3) + k × (+ 4) − k × (+ 3)] − [ k × (− 1) × (+ 2) + k × (− 1) − k × (+ 2)]
⇒ W AB = [12k + 4k − 3k ] − [ − 2k − k − 2k ] = 13k − (− 5k ) = + 18k
Réponse C
Question n°6 :
force conservative ? Oui
Wab = [- k(x-y)] à prendre entre (-1,2) et (4,2)
= -k(xb-yb –xa+ya)
Wab = -5k
Question n° 7 :
force conservative ? oui
Wab= [k(x²/2 – xy)]AB
= k (xb²/2 –yb x b – xa²/2 +ya xa )
= -3k
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 120](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-120-320.jpg)
![Question n°8 :
On demande de dériver 2 fois par rapport à x ce que l’on fait à la suite
Rappel : ∂ x∂ y∂ x = ∂ x ²∂ y = ∂ y∂ x ²
On commence à dériver par rapport à x :
∂f
= 2 y ² + 2 x ln y + 2e x + 3 y
∂x
∂²f
= 2 y ² + 2 ln( y ) + 4e 2 x
∂ x²
∂3f 2
= 4y +
∂ x²∂ y y
Question n°9 :
force conservative, oui
Wab= [-k(x²/2+xy + y²/2)]AB entre A(3,-1) et B(2,2)
= - k( xb²/2 +xbyb + yb²/2) – (xa²/2 +xaya+ ya²/2)
= -6k
Question n° 10 :
Il s’agit ici de dériver une fonction à 2 variables.
Il faut d’abord dériver par rapport à x, puis dériver par rapport à y.
∂ f ( x, y ) 2
= − 2 xy + y
∂x y
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 121](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-121-320.jpg)
![Question n°11 :
Force conservative, oui.
Wab=[kx(y+1)]AB avec A(1,1) et B(2,3)
Wab= k( xb(yb+1)-xa(ya+1) )= 6k
Question n° 12 :
A) Par exemple, une source sonore émet des sons. Chaque onde est une ligne de
niveau où l’on entend le même niveau sonore tant que l’on reste à une distance
constante de la source.
z
grad f P=m v
jk
i y
x
B) attention !!!
L’énergie potentielle a un sens opposé au travail,
Il faut se rappeler que F = − grad Ep
D) le gradient est un vecteur qui exprime la variation spatiale d'un scalaire
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 122](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-122-320.jpg)









![QCM 13 :
B B T² 260² − 360²
Q AB = ∫ A
ncdT = n ∫ 17 + 20 × 10 − 3 TdT = n 17T + 20 × 10 − 3 = n 17 × − 100 + 20 × 10 − 3
A
2 2
− 6.2 × 10 4
= n − 1700 + 20 × 10 − 3 = 2.5 × − 2320 = − 5800 J
2
QCM 14 :
B B T² T3
Q AB = ∫ A
n.c.dT = n ∫ 7,70 + 5,5 × 10 − 3 T − 0,83 × 10 − 6 T ² dT = n 7,70T + 5,5 × 10 − 3
A
²
− 0,83 × 10 − 6
3
300² − 280² 300 3 − 280 3
= n 7,70(300 − 280) + 5,5 × 10 − 3 − 0,83 × 10 − 6
2 3
3² × 10 4 − 2,8² × 10 4 33 × 10 6 − 2,83 × 10 6
= n 7,7 × 20 + 5,5 × 10 − 3 − 0,83 × 10 − 6
2 3
1,16 × 10 4
5,1× 10 11
6
= n 154 + 5,5 × 10 − 3 − 0,83 × 10 − 6 = [154 + 31,9 − 1,41] = 0,25 × 184,49 = 46cal
2 3 44
QCM 15 :
492
dt = − m[141T − 492 ln T ]
B A
Q AB = ∫A m.c .dT = − m ∫ 1,41 −
'
B T
= m[1,41× 225 − 492( Ln 298 − Ln523)]
523
= − 100 × 317,25 − 492 Ln ≈ − 100 × 41,73 ≈ − 4173 J
298
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 132](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-132-320.jpg)






















![10 5 −3
Donc Wmonotherme = 16.10 2 ( 5
− 1) = 16.10 2 X ( ) = − 1200 J
4.10 4
Réponse C
QCM 3 :
∂ Qr
dS =
T
∂ Qr m.c' (T )
⇒ ∆S = ∫ T .dT = ∫ T .dT
Attention : il faut exprimer toutes les données dans les unités adéquates :
m = 100 g = 10 − 1 kg , T A = 17° C = 17 + 273 = 290 K et TB = 80° C = 80 + 273 = 353K
10 − 1 X ( 292 + 2.10 − 3 T ²) 29,2 2.10 − 4 T ²
Donc : ∆ S AB = ∫ T
.dT = ∫
T
.dT + ∫
T
.dT
29,2 T²
⇒ ∆ S AB = ∫ .dT + ∫ 2.10 − 4 T .dT = [29,2 ln T ] B + [2.10 − 4 X ] B
A A
T 2
T
⇒ ∆ S AB = 29,2 X (ln TB − ln T A ) + 10 − 4 X (TB2 − T A2 ) = 29,2 ln B + 10 − 4 X (TB2 − T A2 )
TA
353
⇒ ∆ S AB = 29,2 ln + 10 − 4 X (353² − 290²) ≈ 9,8 J .K − 1
290
Réponse B
QCM 4 :
∆F = Wr
Le gaz est supposé parfait.
pB
⇒ ∆ F = Wisotherme = n.R.T0 . ln
pA
Attention de bien exprimer les données dans les unités adéquates :
T0 = 17° C = 17 + 273 = 290 K (il est ici possible de laisser p A et p B en atm car ces valeurs
vont être employées dans un rapport).
3
⇒ ∆ F = 0,04 X 8,31X 290 X ln ≈ 106 J
1
Réponse D
(normalement, ln3 vous sera donné dans l’énoncé le jour du concours)
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 155](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-155-320.jpg)
![QCM 5 :
∆F = Wr
Il s’agit d’un gaz parfait.
pB
⇒ ∆ F = Wisotherme = n.R.T0 . ln
pA
Attention : la température doit être exprimée en kelvins !
T0 = 107° C = 107 + 273 = 380 K (il est ici possible de laisser p A et p B en atm car ces valeurs
vont être employées dans un rapport).
10
⇒ ∆ F = 3 X 8,31X 380 X ln ≈ 15247 J
2
Réponse D
(normalement, ln3 vous sera donné dans l’énoncé le jour du concours)
QCM 6 :
∂ Qr
dS =
T
∂ Qr ∂ Qr 1 Qisotherme
⇒ ∆S = ∫ .dT = ∫ .dT = ∫ ∂ Q .dT = T0
r
T T0 T0
Or il s’agit d’un gaz parfait donc : Wisotherme = − Qisotherme
⇒ Qisotherme = − ∆ F = − 15247 J
− 15247
⇒ ∆S = ≈ − 40,1J .K − 1 (attention au signe !)
380
Réponse B
QCM 7 :
Attention : il s’agit de la chaleur reçue par la source de chaleur !
C’est donc l’opposé de la chaleur reçue par le système : QSC = − Q
Q= ∫ C (T ).dT
⇒ Q = − ∫ 2,3 + 4.10
SC
−4
T.dT = − [2,3T + 2.10 − 4 T ²]900
400
⇒ QSC = − [2,3 X (400 − 900) + 2.10 − 4 (400² − 900²)]
⇒ QSC = − [230 X (− 5) + 2.10 − 4 X 10 4 (16 − 81)] = − [− 1150 + 2 X (− 65)]
⇒ QSC = − [− 1150 + 2 X (− 65)] = − (− 1280) = + 1280 J (attention au signe !)
Réponse B
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 156](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-156-320.jpg)
![QCM 8 :
D’après le second principe : dS = ∂ e S + ∂ i S
⇒ ∆ iS = ∆ S − ∆ eS
δ Qr C (T ) 2,3 + 4.10 − 4 T
∆S = ∫ T .dT = ∫
T
.dT = ∫
T
.dT
2,3
⇒ ∆S = ∫ .dT + ∫ 4.10 − 4.dT = [2,3 ln T ]900 + [ 4.10 − 4 T ]900
400 400
T
400 2 2
⇒ ∆ S = 2,3 ln + 4.10 X (400 − 900) = 2,3 X ln + 4.10 − 4 X (− 500)
−4
900 3
⇒ ∆ S = 4,6 X (ln 2 − ln 3) − 0,2 ≈ 4,6 X (0,7 − 1,1) − 0,2 ≈ − 2,04 J .K − 1
Qi Q − QSC − 1280
∆ eS = = = = = − 3,2 J .K − 1
Tf Tf Tf 400
⇒ ∆ i S = − 2,04 − (− 3,2) = − 2,04 + 3,2 = 1,16 ≈ 1,14 J .K − 1 (approximation due aux arrondis pris
pour les calculs de ln)
Réponse E
QCM 9 :
Il s’agit d’un gaz parfait.
p
Wmonotherme = n.R.T0 ( B − 1)
pA
p W
⇒ B − 1 = monotherme
pA n.R.T0
W
⇒ p B = p A X monotherme + 1
n.R.T
0
Attention : la température doit être exprimée en kelvins !
T0 = 257° C = 257 + 273 = 530 K
p A et p B ont laissées en atm car ces valeurs vont être employées dans un rapport.
La source de chaleur fournit QSC = 8038 J donc le système reçoit Qmonotherme = 8038 J .
Or il s’agit d’un gaz parfait donc Wmonotherme = − Qmonotherme .
− 8038
⇒ pB = 8X + 1 ≈ 0,7 atm
2 X 8,31X 530
Réponse B
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 157](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-157-320.jpg)


![QCM 15 :
Q= ∫ n.c(T ).dT
⇒ Q = ∫ 2 X (15,1 + 30,1.10 −3
T ).dT = 2 X [15,1T + 15,05.10 − 3 T ²] 460
290
⇒ Q = 2 X [15,1X (460 − 290) + 15,05.10 − 3 (460² − 290²)]
⇒ Q = 2 X [151X 17 + 15,05.10 − 3 X 10² X (46² − 29²)]
⇒ Q = 2 X [2567 + 15,05.10 − 1 X (2116 − 841)] ≈ 8972 J
Réponse C
QCM 16 :
∂ Qr
dS =
T
δ Qr n.c(T ) 2 X (15,1 + 30,1.10 − 3 T )
⇒ ∆S = ∫ T .dT = ∫
T
.dT = ∫
T
.dT
2 X 15,1
⇒ ∆S = ∫ .dT + ∫ 2 X 30,1.10 − 3.dT = 30,2 X [ln T ] 460 + 60,2.10 − 3 [T ] 460
290 290
T
460
⇒ ∆ S = 30,2 X ln + 60,2.10 − 3 X (460 − 290)
290
46
⇒ ∆ S = 30,2 X ln + 60,2.10 − 3 X 170 ≈ 24,2 J .K − 1
29
Réponse B
QCM 17 :
1) ∆ S SC = − ∆ e S
Q
Or ∆ e S =
Tf
8972
⇒ ∆ S SC = − ≈ − 19,5 J .K − 1
460
Vrai
2) D’après le second principe : dS = ∂ e S + ∂ i S
⇒ ∆ iS = ∆ S − ∆ eS
Or ∆ e S = − ∆ S SC donc ∆ e S = 19,5 J .K
−1
⇒ ∆ i S = 24,2 − 19,5 = 4,7 J .K − 1
Vrai
© Tous droits réservés au Tutorat Associatif Toulousain
Sauf autorisation, la vente, la diffusion totale ou partielle de ce polycopié sont interdites 160](https://image.slidesharecdn.com/polybiophysiquer10-11-120519035137-phpapp01/85/Poly-biophysique-r-10-11-160-320.jpg)
