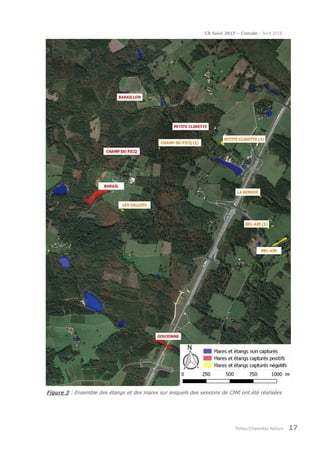
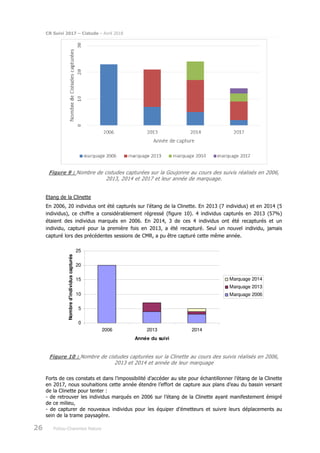
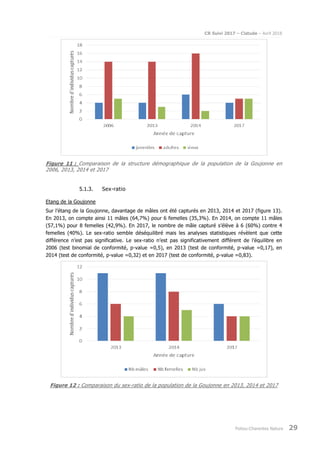
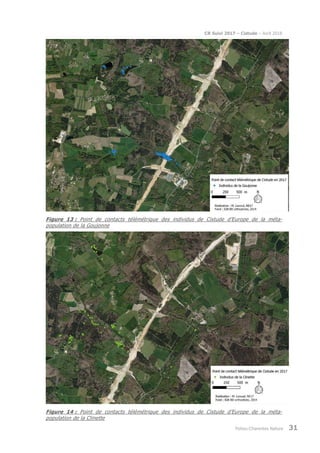
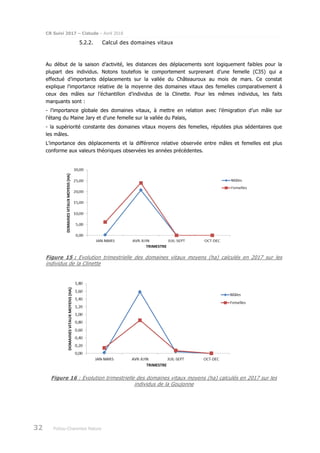
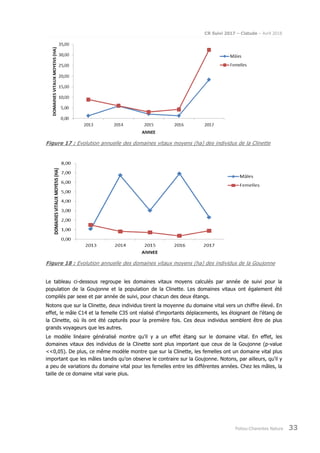
Le rapport présente le suivi de la population de cistude d'Europe (Emys orbicularis) dans la double saintongeaise, réalisée dans le cadre de la LGV SEA pour la quatrième et cinquième année, incluant des analyses par capture-marquage-recapture et télémétrique. L'étude vise à évaluer les impacts potentiels de la LGV sur cette espèce protégée, ses habitats et son comportement. Les résultats sont comparés à ceux des années précédentes pour déterminer les évolutions de la population et des habitudes de déplacement.