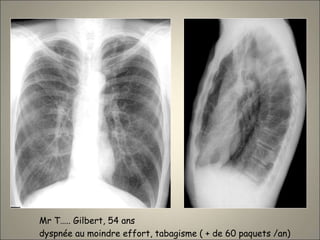
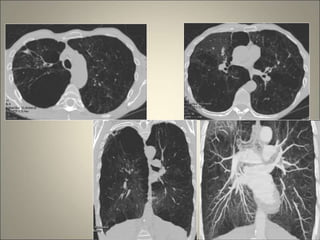
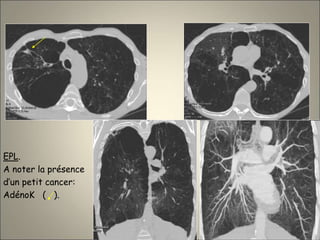
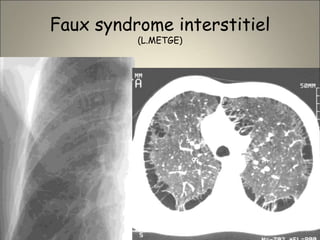
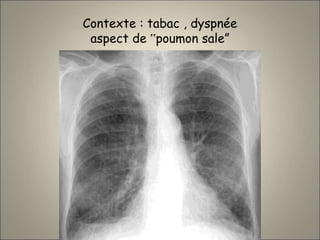
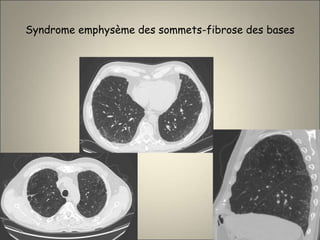
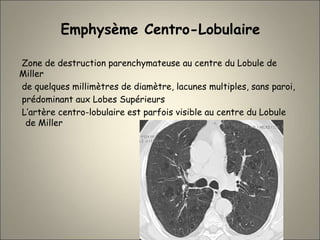
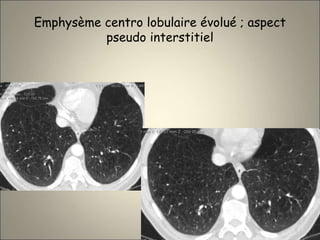
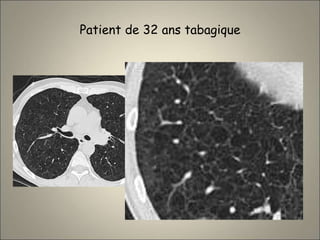
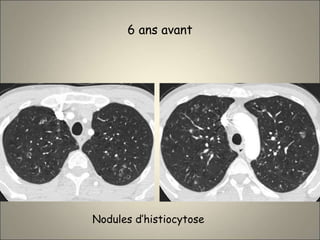
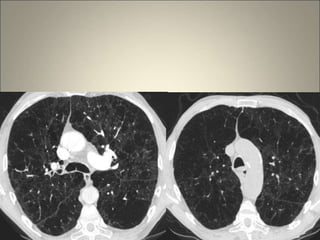
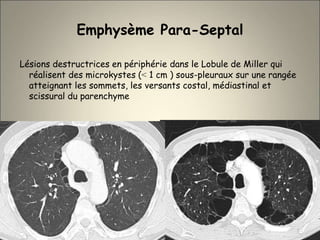
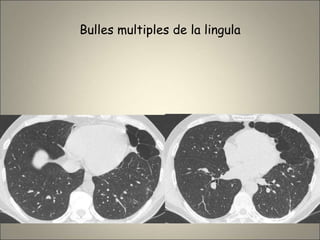
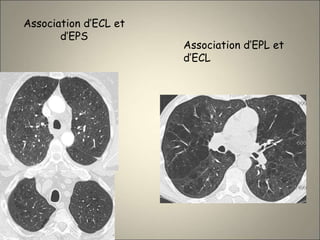
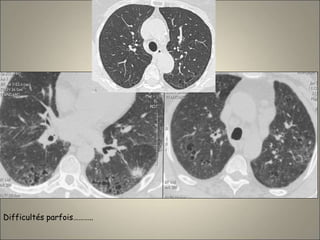
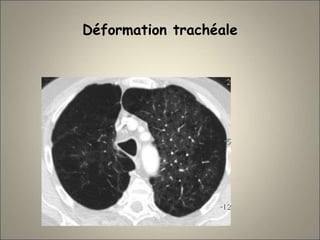
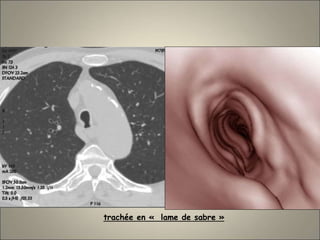
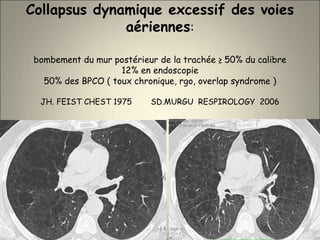
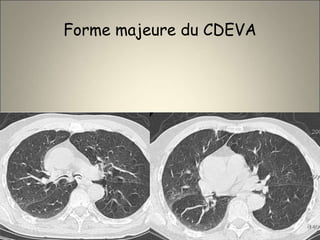
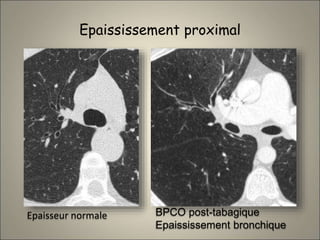
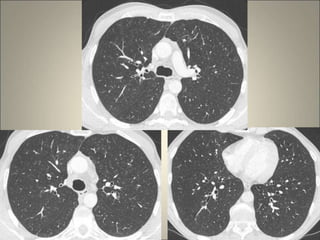
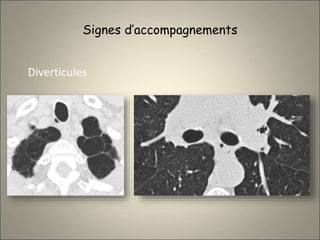
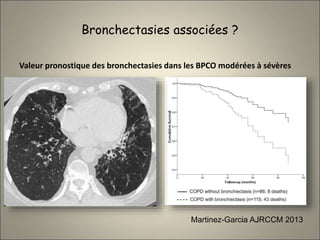
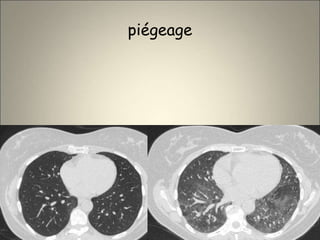
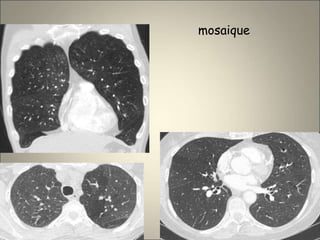
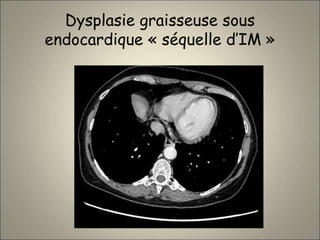
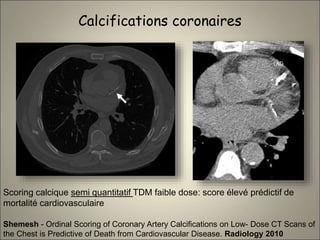
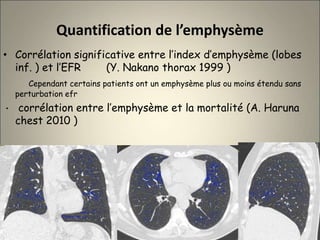
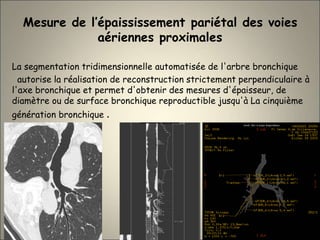
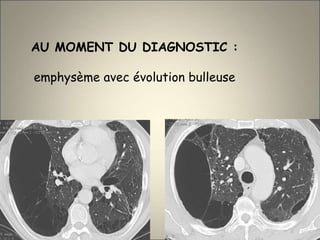
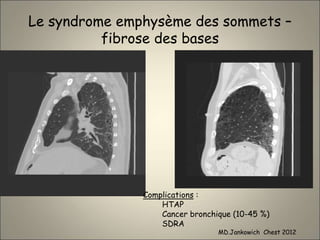
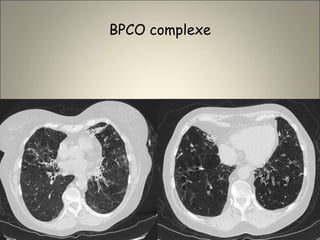
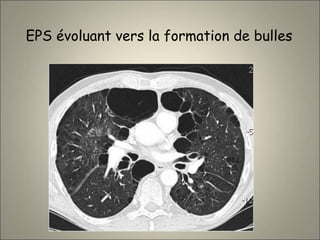
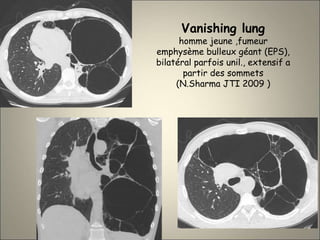
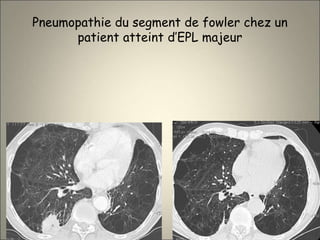
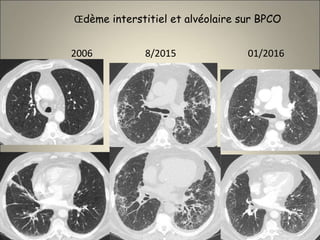
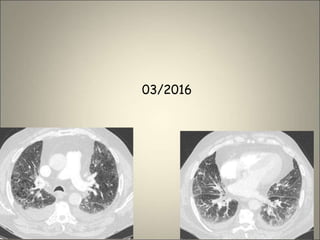
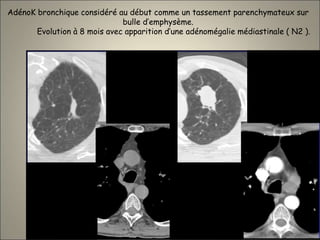
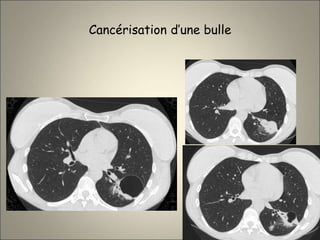
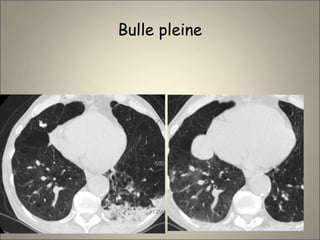
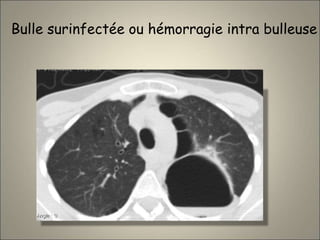
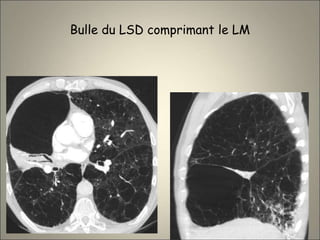
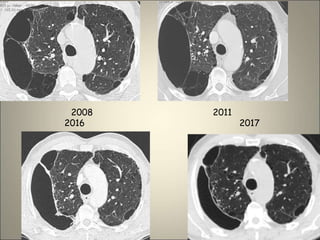
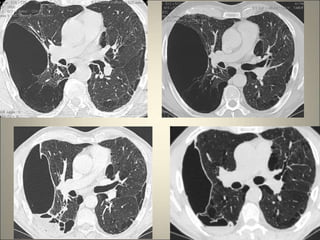
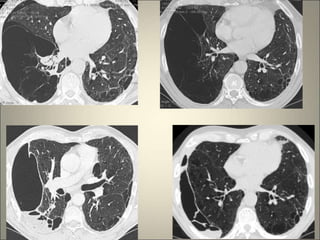
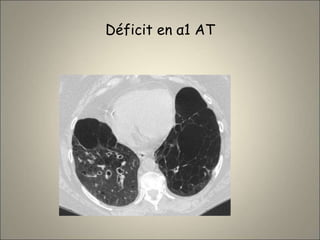
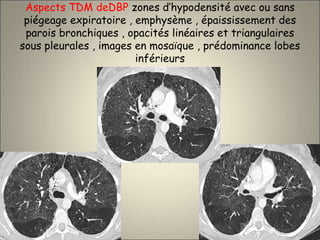
Le document traite de l'importance de l'imagerie dans le diagnostic et le suivi de la BPCO, soulignant la nécessité de radiographies thoraciques et de TDM pour évaluer l'état des patients. Il aborde également les différents types d'emphysème et les complications associées, ainsi que les techniques d'imagerie recommandées pour un suivi efficace. Enfin, il souligne les facteurs prédictifs d'aggravation et l'importance du respect des protocoles d'imagerie dans la gestion des patients atteints de BPCO.