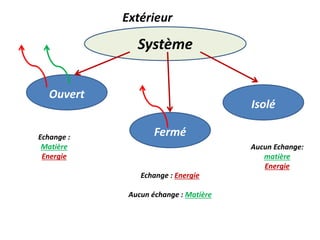
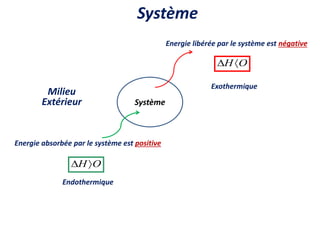
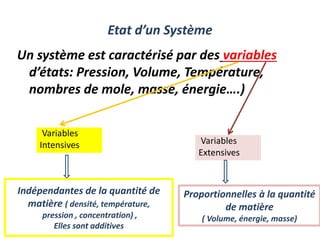
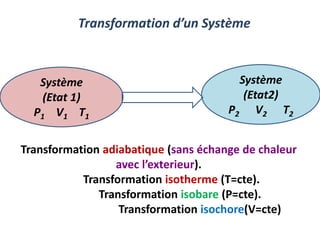
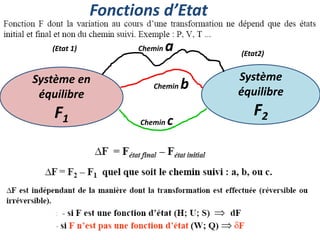
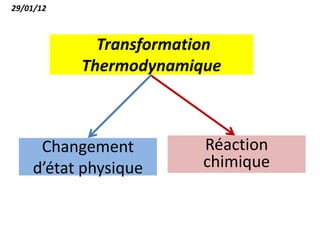
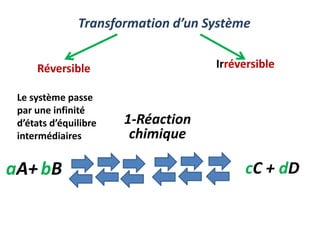
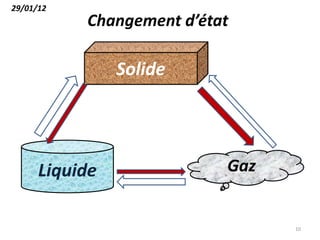
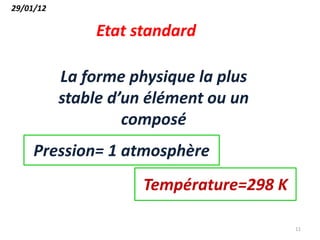
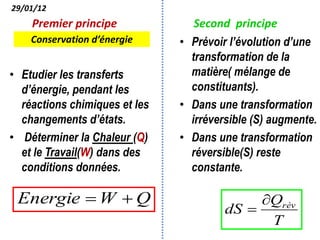
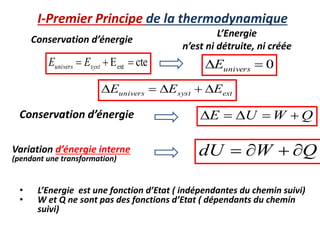
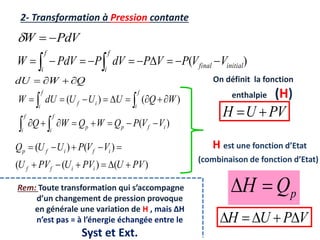
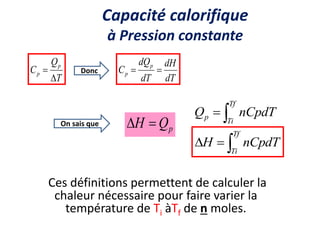
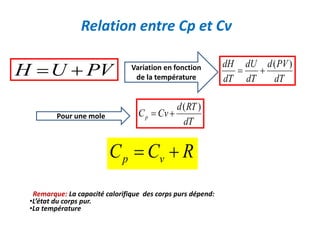
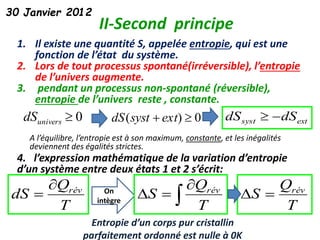
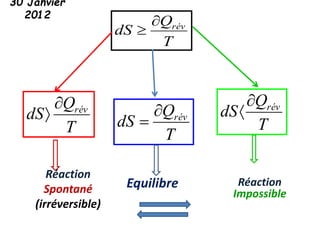
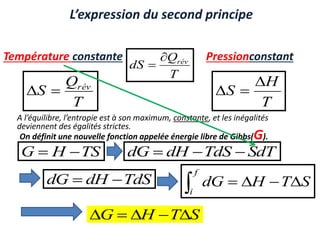
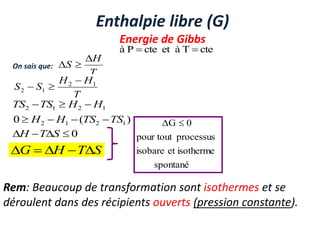
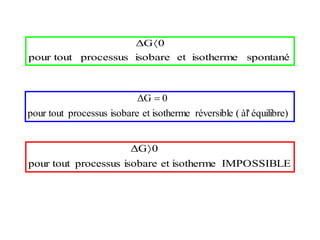
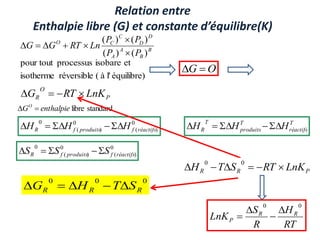
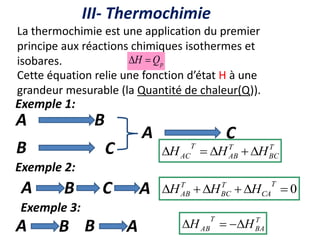
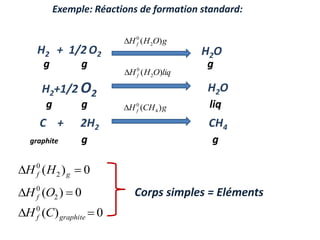
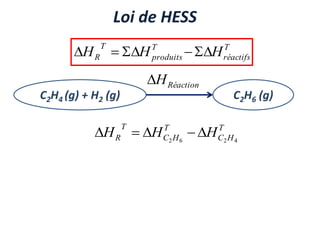
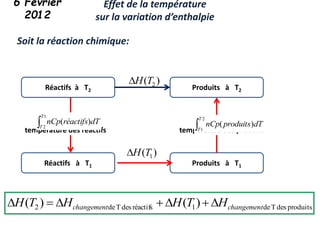
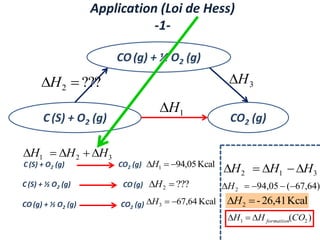
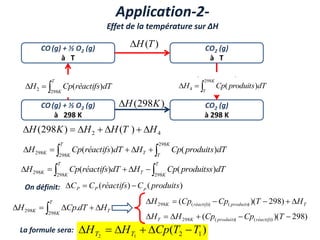
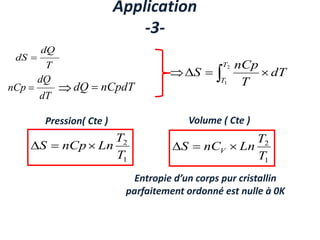
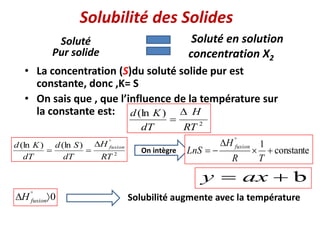
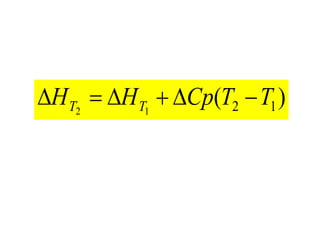Le document présente une introduction à la thermodynamique, abordant les concepts clés tels que l'énergie interne, l'entropie, et les transformations thermodynamiques. Il explique les premiers et seconds principes de la thermodynamique, ainsi que les notions d'enthalpie et de chaleur spécifique. En outre, il discute des transformations réversibles et irréversibles, ainsi que des applications pratiques comme la thermochimie.