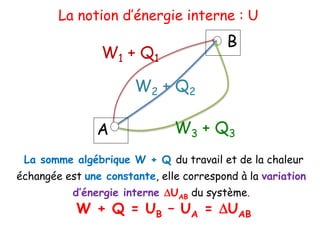
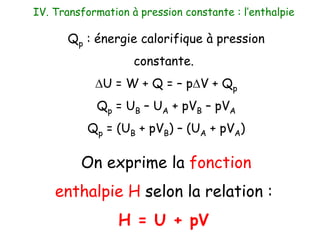
Ce document traite de la thermodynamique chimique, notamment des lois régissant les échanges d'énergie dans les systèmes chimiques. Il présente les concepts de systèmes ouverts, fermés et isolés, ainsi que les notions d'énergie interne et d'enthalpie, et explique les transformations et les réactions exothermiques et endothermiques. Enfin, il aborde les variables d'état et les principes de conservation de l'énergie lors des transformations thermodynamiques.