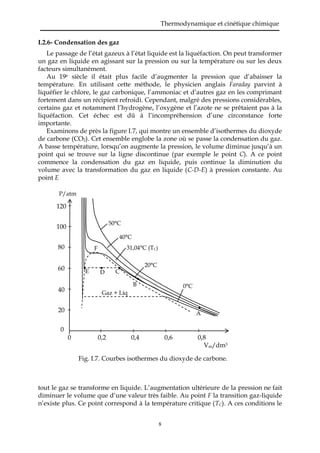
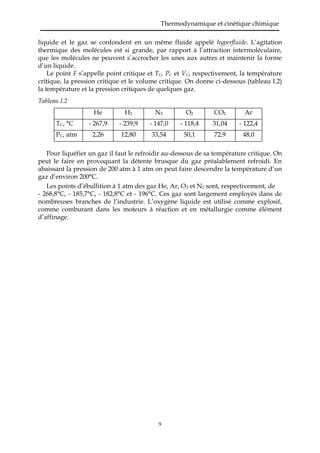
Le document traite des fondements de la thermodynamique et de la cinétique chimique, en se concentrant sur les états de la matière et les lois des gaz parfaits et réels. Il explique les différences entre les solides, liquides et gaz, ainsi que les principes régissant le comportement des gaz selon la théorie cinétique. Le document aborde également les équations d'état des gaz parfaits, les notions de pression partielle et les corrections nécessaires pour traiter des gaz réels.