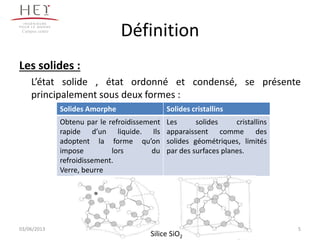
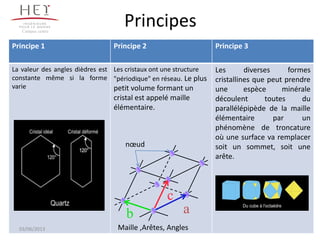
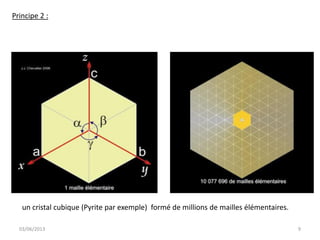
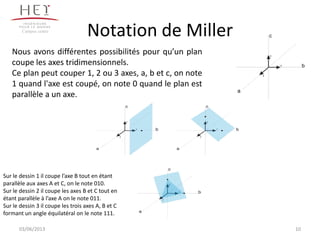
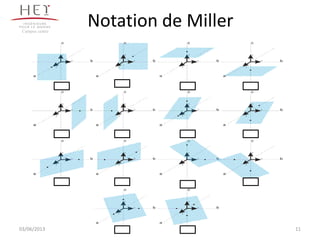
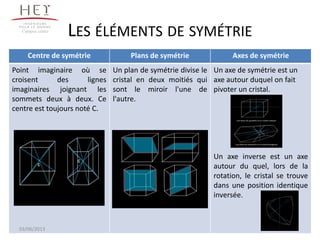
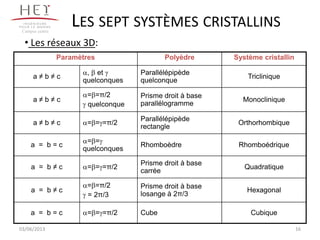
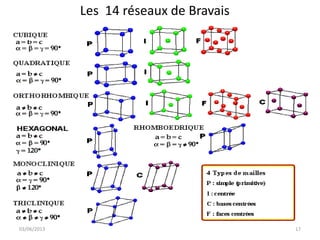
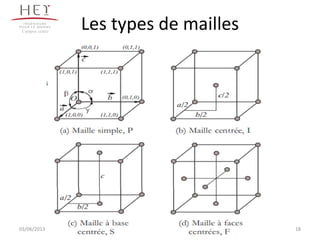
La cristallographie est une science qui étudie la formation et les caractéristiques géométriques des cristaux, distinguant entre solides cristallins et amorphes. Le document couvre les principes des structures cristallines, la notation de Miller, les systèmes et réseaux cristallins, ainsi que les types de défauts présents dans les cristaux. Les caractéristiques telles que la masse volumique, la coordinance et la compacité sont également abordées, illustrant leur impact sur les propriétés matérielles.