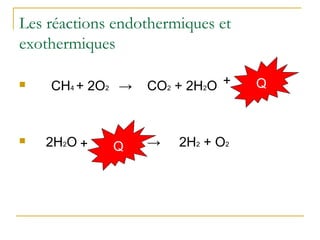
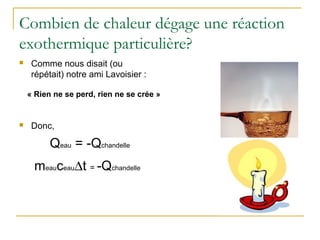
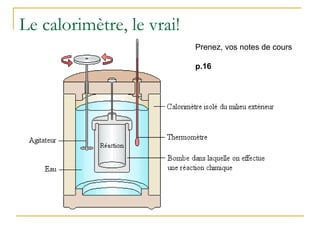
La présentation traite de la calorimétrie, en expliquant les réactions endothermiques et exothermiques ainsi que les calculs associés. Elle présente des exemples numériques pour démontrer comment calculer l'énergie échangée lors de ces réactions. Enfin, elle annonce des activités pratiques et des évaluations à venir dans le cours.